Дабы быть последовательным, я рекомендую вернуться и перечитать ряд публикаций, которые последовательно подведут тебя к сегодняшней теме.
- Сохранение и формирование десневого контура: от простого к сложному и наоборот. Часть I. — вводные сведения о слизистой оболочке полости рта, платформах имплантатов и компонентах имплантационных систем, предназначенных для этапа формирования десневой манжеты.
- Сохранение и формирование десневого контура: от простого к сложному и наоборот. Часть II. — мукогингивопластика как этап имплантологического лечения, методы мукогингивопластики, анализ показаний и противопоказаний к пластике десны, а также способы снизить необходимость этого хирургического вмешательства путём правильного подбора компонентов для формирования десневой манжеты.
- Коллагеновая матрица Geistlich Mucograft — почему, как, зачем и каким образом? Часть I. — начальная статья о первой коллагеновой матрице, её свойствах и принципах действия.
- Коллагеновая матрица Geistlich Mucograft — почему, как, зачем и каким образом? Часть II. — хирургическая тактика использования коллагеновых матриц на примере операции вестибулопластики, показания и противопоказания.
- Периимплантит. Часть I: Причинно-следственные связи
- Периимплантит. Часть II: Профилактика и лечение
- Лечение периимплантита за 8 шагов — краткая выжимка из двух предыдущих статей специально для тех, кто не любит много читать.
- С исторической точки зрения будет интересно оглянуться назад и посмотреть все публикации, начиная с нашего первого знакомства с коллагеновыми матрицами — хэштег Mucograft или Geistlich в помощь.
Уважаемые друзья, сегодня мы поговорим о коллагеновой матрице Fibro-Gide. Это еще один биоматериал, предназначенный для пластики десны и известный мне, по крайней мере, с 2014 года. Да-да, вы не ослышались — впервые о концепте подобного материала и самом названии Fibro-Gide я узнал почти десять лет назад, когда в составе первой российской делегации побывал на фабрике Geistlich Pharma в швейцарском Вольхусене (кантон Люцерн):
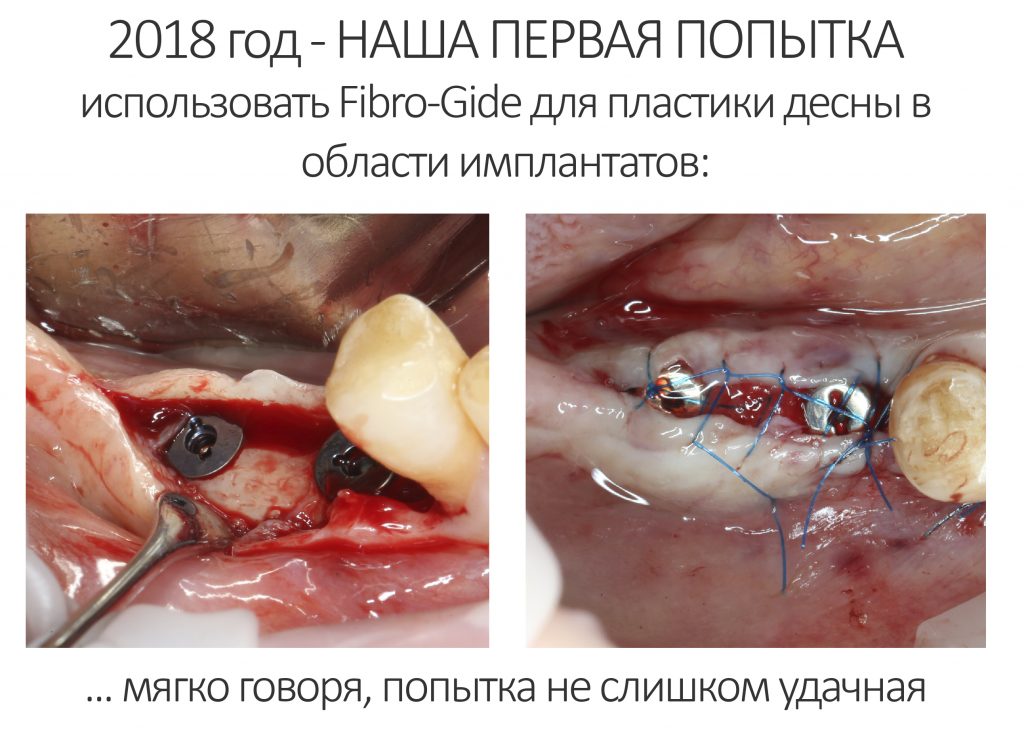
В 2018 году мы впервые использовали Fibro-Gide в нашей клинике. В России он еще не продавался, поэтому я специально летал за ним в Германию.
Наперёд замечу, что результаты первого использования Fibro-Gide были, мягко говоря, неоднозначными. И, тем не менее, с 2018 года мы накопили более, чем достаточный опыт использования коллагеновых матриц в разных клинических ситуациях, в том числе Fibro-Gide. Сегодня я расскажу вам о наших наработках и поделюсь своими рассуждениями об этой разновидности биоматериалов.
Важная ремарка. Исторически сложилось так, что в нашей Уютной КЛИНИКЕ ИН мы используем только материалы компании Geistlich Pharma, а потому накопили чрезвычайно большой опыт работы с ними. Этот опыт, как положительный, так и отрицательный, является темой сегодняшней публикации, основная цель которой отнюдь не стимуляция продаж Fibro-Gide, а снижение количества ошибок и предотвращение косяков при его использовании. Компания Geistlich не имеет никакого отношения к этой статье. Более того, её мнение расходится с моим по целому ряду вопросов. Иными словами, это не реклама.
В отличие от большинства коллег и значительного числа производителей биоматериалов, я глубоко убежден в том, что
- не существует волшебных биоматериалов. Будучи биосовместимыми или биоинертными, биоматериалы не влияют или почти не влияют на физиологические процессы в органах и тканях, в т. ч. на регенерацию. Влияние биоматериалов на организм определяется, исключительно качеством и чистотой их производства. Чем оно меньше — тем лучше.
- по факту, все биоматериалы-графты ухудшают качество костной ткани, так и десны. Поэтому использование биоматериалов должно быть, как минимум, обоснованным и оправданным с точки зрения предполагаемого результата и рисков возможных осложнений.
- при всех своих положительных свойствах, биоматериалы никогда не смогут в полной мере заменить собственные ткани организма. Регенерат, который мы получаем в результате использования графта, нельзя назвать полноценной костной тканью или десной. Поэтому дальнейшая работа с ним требует известной осторожности.
- использование биоматериалов — это всегда компромисс. Мы используем их лишь по одной причине — у нас нет или почти нет выбора. Альтернативные варианты хирургического вмешательства, если возможны вообще, получаются значительно более травматичными и опасными для пациента.
- удовлетворительные долгосрочные результаты хирургического лечения мы можем получить, применяя биоматериалы абсолютно любых производителей. Если и есть между ними какая-то разница, то она, в первую очередь в физических свойствах и микроструктуре, во многом определяющих удобство их использования. По аналогии с имплантатами: какой бы ни была имплантационная система, существуют единые и наиболее общие для всех правила имплантологического лечения, коих стоит придерживаться.
Собственно, кому из производителей понравятся эти тезисы? Но не стоит забывать, где собака и где её хвост:
Задача производителей — своей продукцией облегчить работу хирургов, сделать её более удобной и безопасной, а не превратить докторов в менеджеров по продажам биоматериалов. Задача докторов — использовать биоматериалы для снижения сложности, травматичности и рисков осложнений хирургических материалов, а не продавать их.
Я уже писал об этом, когда рассказывал о биоматериалах для наращивания костной ткани. Однако, по порядку.
Десна, её параметры и значение для имплантологии.
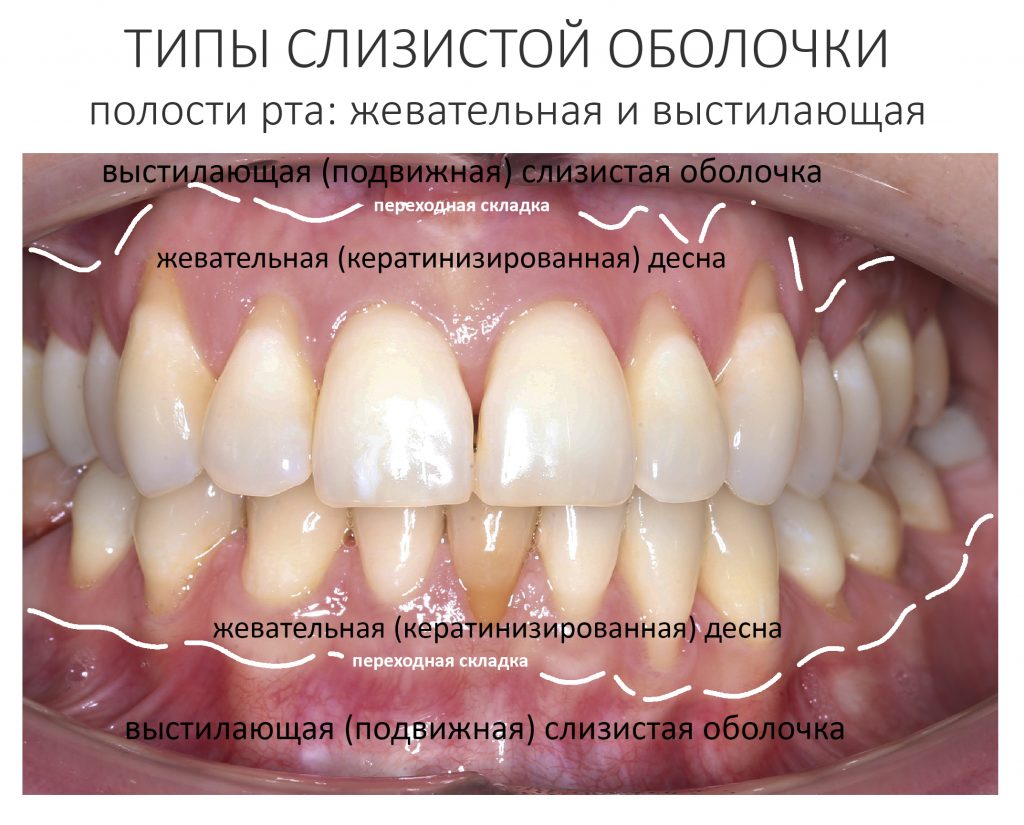
Для тех, кому лень перечитывать вот это, я напомню, что по своим морфофункциональным свойствам слизистая оболочка полости рта делится на выстилающую и жевательную.
В различных источниках названия типов слизистой полости рта могут отличаться: «подвижная и прикреплённая», «кератинизированная и некератинизированная», а то и просто «десна» и «слизистая». На мой взгляд, определения «выстилающая» и «жевательная» наиболее внятно отражают морфологию и функцию слизистой оболочки, поэтому я буду пользоваться именно этими терминами.
Жевательная слизистая оболочка (то, что мы обычно называем десной), наиболее плотная, толстая и практически неподвижная, покрывает те участки альвеолярного гребня и нёба, на которые приходится основная механическая нагрузка во время жевания. Постоянный контакт с травмирующими кусочками пищи снизил её чувствительность, повысил прочность и способность к регенерации — это очень важно. Её ключевая функция — защита альвеолярного гребня, зубов и периодонта. Подслизистый слой отсутствует, фактически, десна срастается с надкостницей, что обуславливает её неподвижность и низкую чувствительность к механическим нагрузкам.
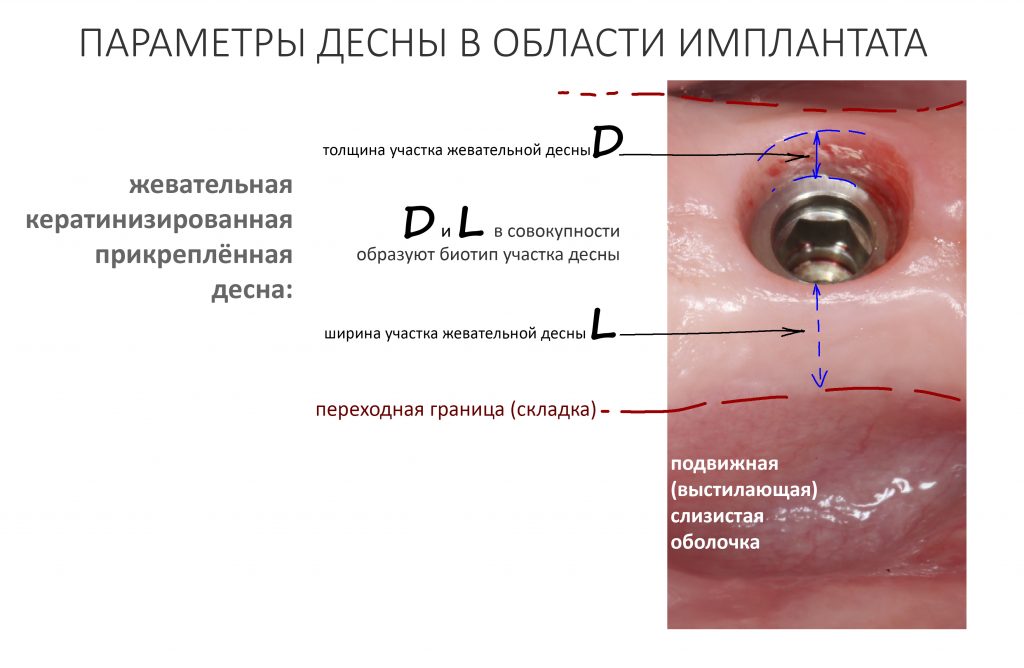
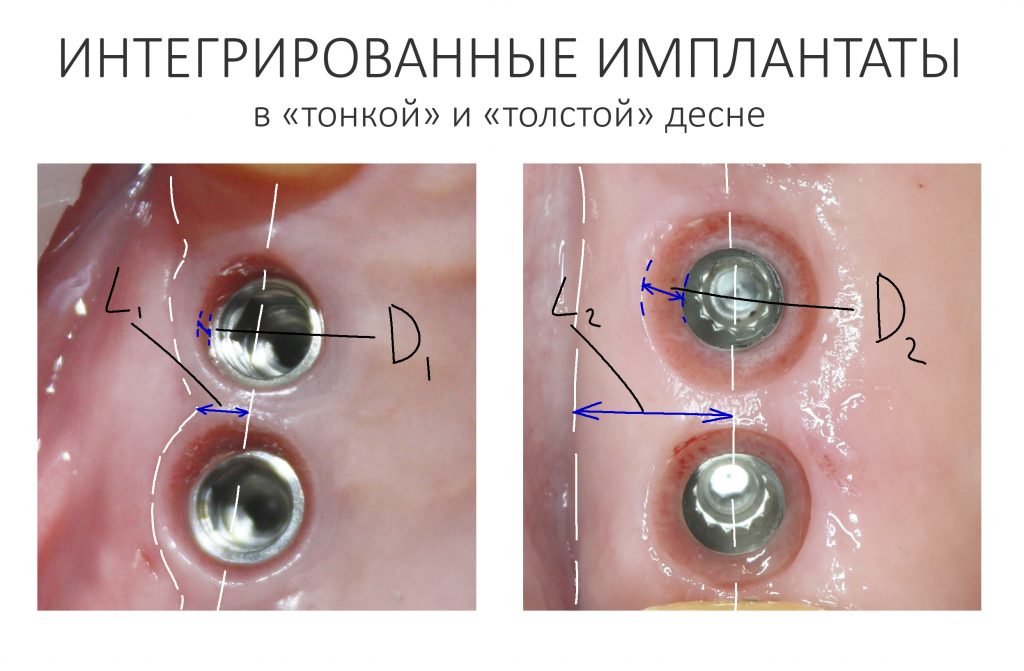
Десна (жевательная слизистая оболочка) имеет два важных, с клинической точки зрения, параметра: ширину участка и толщину.
В совокупности, они образуют т. н. «биотип», совокупность оцениваемых визуально морфологических характеристик слизистой оболочки. Мы можем выделить несколько биотипов, но чаще просто говорим о «толстой» или «тонкой» десне.
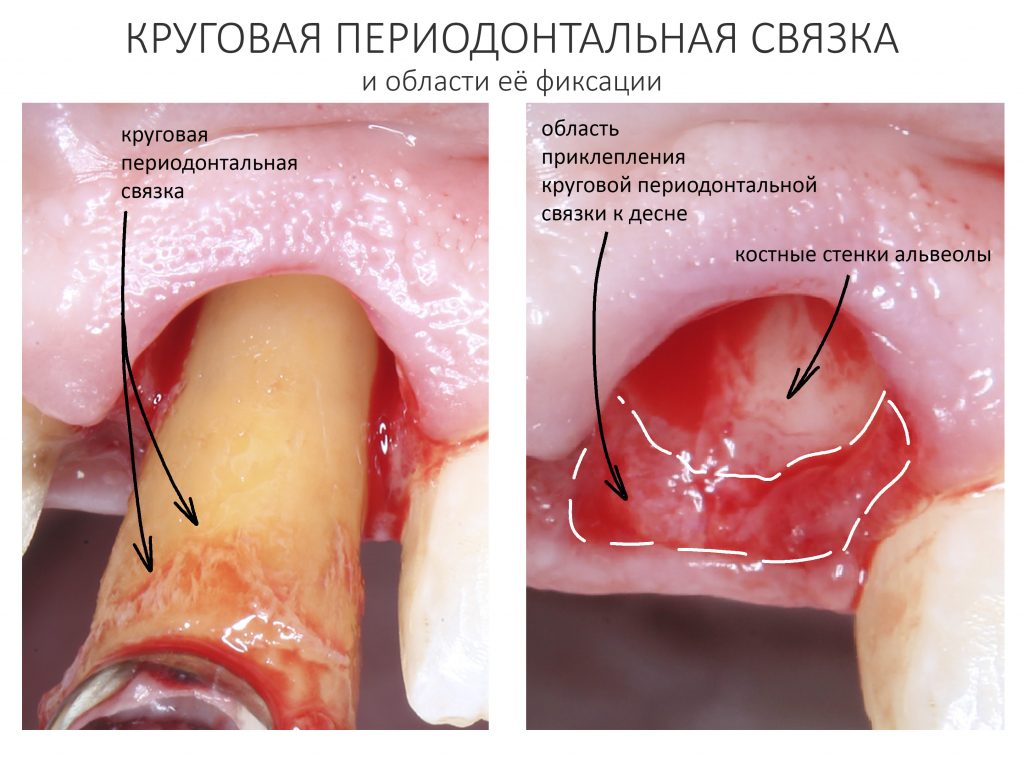
В области естественных зубов десна участвует в формировании периодонта. Часть периодонтальных волокон вплетаются в неё в области шейки зуба, образуя круговую периодонтальную связку.
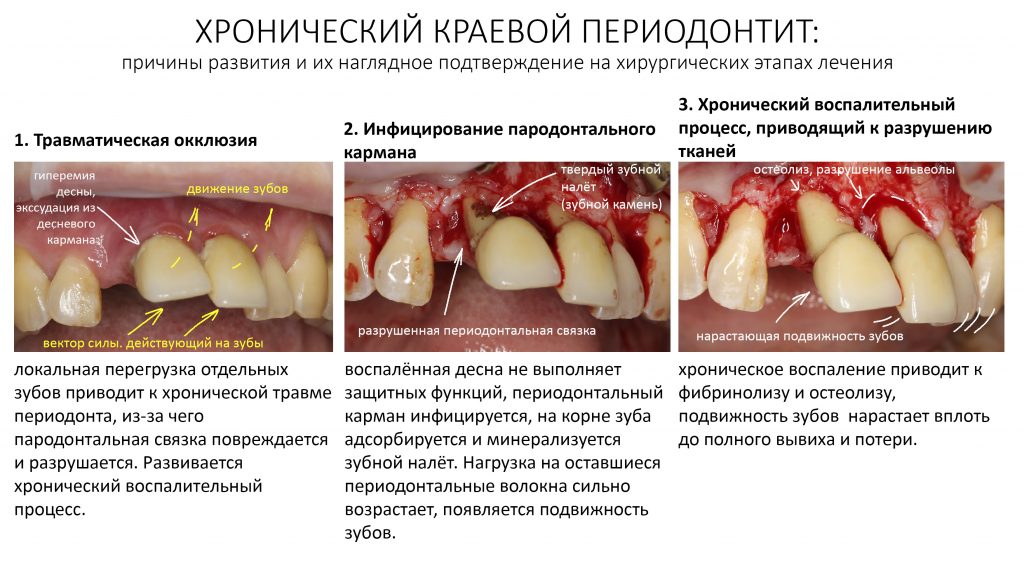
Плохая гигиена полости рта, чрезмерное растяжение и разрыв периодонтальных волокон, связанные с перегрузкой зубов, приводят к одному из самых неприятных и сложных в лечении стоматологических заболеваний — краевому периодонтиту (пародонтиту), в этиологии которого лежит хроническая травма, осложнённая инфекционным воспалительным процессом
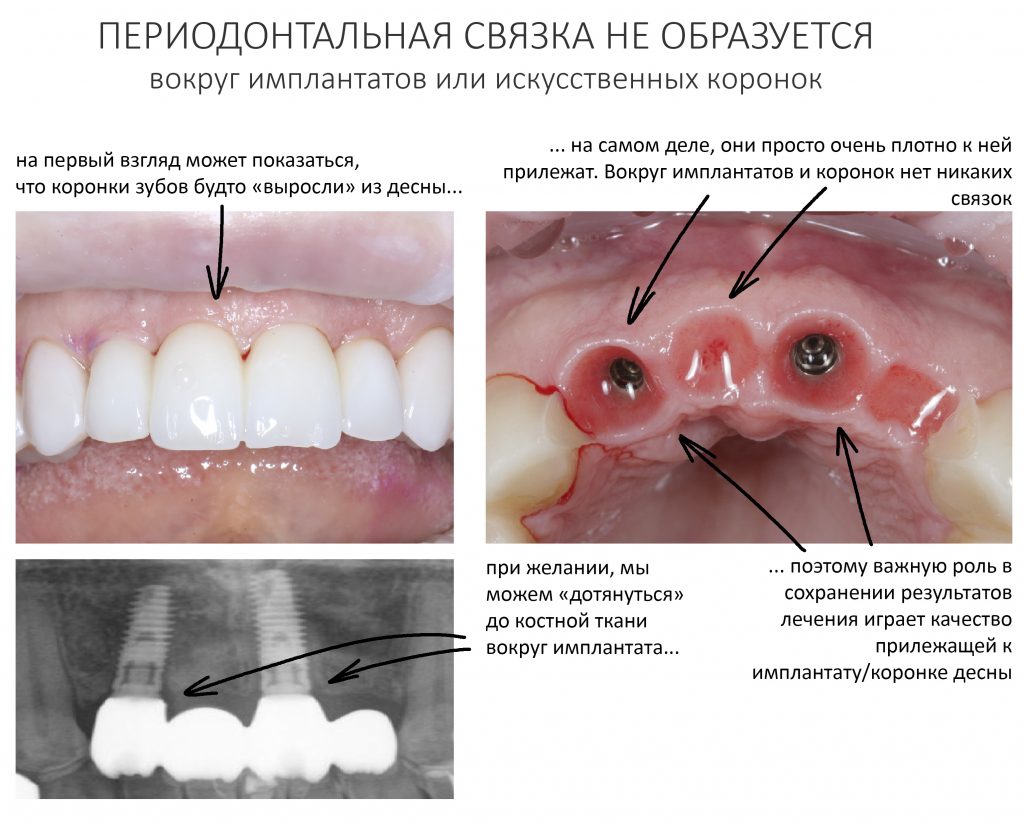
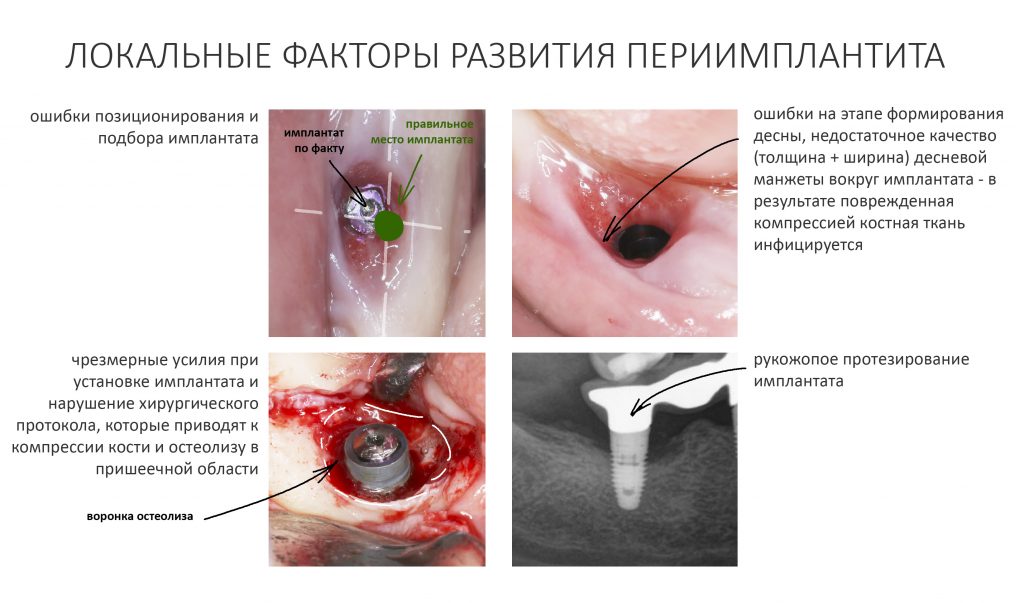
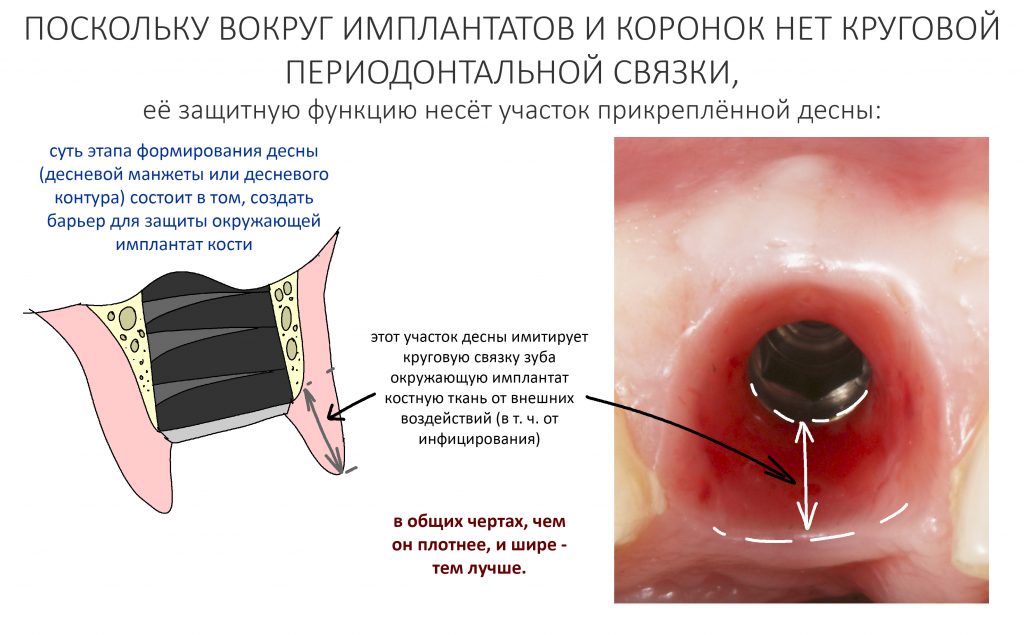
Ежу понятно, что вокруг имплантатов или коронок, опирающихся на имплантат, никакой периодонтальной связки нет и никогда не будет. Если мы залезем в борозду между коронкой и слизистой, то можем «потрогать» не только сам имплантат, но и окружающую его костную ткань.
Иными словами, окружающая непосредственно имплантат кость совершенно беззащитна перед инфицированием и внешним воздействием. А поврежденная несоблюдением хирургического протокола кость, которую передавили излишним усилием при установке имплантата — тем более.
Развивается периимплантит, представляющий серьезную и весьма распространенную проблему в современной дентальной имплантологии. Периимплантит нельзя вылечить полностью, но можно приостановить, тем самым существенно продлить срок службы имплантатов и повысить качество жизни пациента.
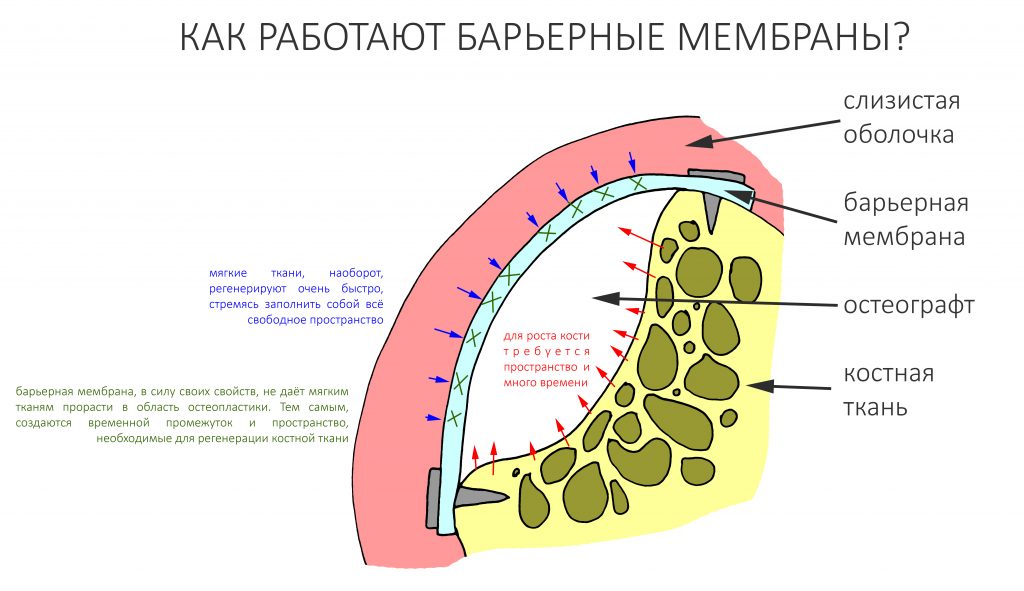
Помимо точного и вдумчивого отношения ко всем хирургическим этапам дентальной имплантации, эту проблему в значительной степени решает этап формирования десневого контура, о котором я писал ранее. Задача этого этапа — создать достаточную по толщине, поверхности и объему плотную десневую манжету вокруг платформы имплантата — играя роль периодонтальной связки, она защищает окружающую имплантат костную ткань и препятствует её повреждению внешними факторами.
Все эти ваши концепции «нулевой убыли костной ткани», «биологической ширины» и т. д. ставят целью создание достаточной по параметрам десневой манжеты, но реализуют её несколько в другом ключе:
Также не стоит забывать о том, что методы «сохранения костной ткани вокруг имплантата», продвигаемые одним прибалтийским фашистом, являются действенными лишь в случае правильного и вдумчивого проведения предыдущих этапов, в противном случае они могут серьезно осложнить ситуацию. И уж точно, исправить рукожопую имплантацию они не в состоянии.
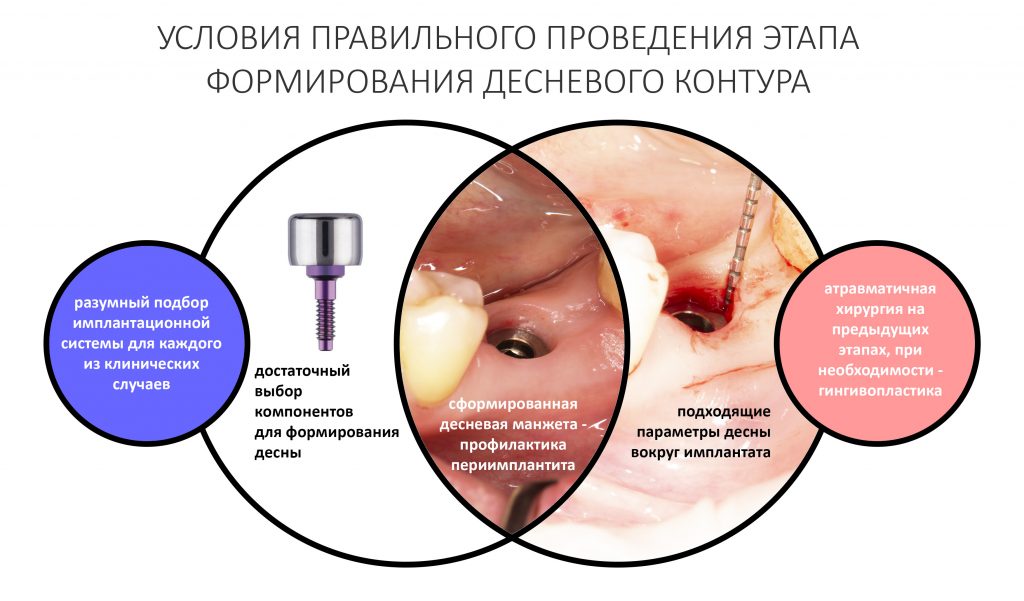
В общем, этап формирования десневого контура важен. Для того, чтобы провести его правильно, нужны соответствующие условия:
- достаточный диапазон компонентов имплантационной системы для формирования или сохранения десны. Об этом речь шла где-то здесь, рекомендую почитать>>
- соответствующий биотип десны, из которой будет формироваться новый контур «прорезывания» искусственного зуба
Первое является более-менее стандартным, относится к конструктиву имплантационной системы и является одним из факторов её выбора для решения клинических задач, что уже обсуждалось неоднократно. Второе — это индивидуальная особенность пациента и конкретной клинической ситуации, никак не зависящая от нас и выбранной нами тактики лечения. Для достижения наилучших и долгосрочных результатов имплантологического лечения, мы должны уделять внимание как первому, так и второму. Так формируется ключевая клиническая задача — изменение биотипа слизистой оболочки в ходе хирургического этапа стоматологической реабилитации.
И прежде, чем мы рассмотрим варианты решения этой клинической задачи, нам стоит отвлечься и изучить коллаген, являющийся не только основным структурным белком нашего организма, но и исходным сырьём для значительного числа используемых нами биоматериалов.
Коллаген — основной структурный белок нашего организма
Если быть точным, то коллаген — это не один, а целая группа белков, отличающихся между собой как молекулярным строением. так и свойствами. Коллаген встречается только у животных — его нет в растениях, бактериях, грибах и т. д. Более того, коллаген — это основной строительный белок нашего (и не только) организма, на его долю приходится до 40% массы тела. Несмотря на распространение, коллаген — одна из самых загадочных и малоизученных биоструктур, ученые продолжают открывать всё новые его типы (сейчас известно около тридцати), расшифровывать структуру, изучать его синтез и распад. Оно и понятно — исследование коллагена открывают широкую дорогу в биоинженерию, к созданию искусственных органов и тканей, лечению огромного количества болезней и т. д. В общем, раскрытие всех тайн этого белка — священный Грааль современной биохимии.
В контексте сегодняшней темы, нам интересуют два момента: строение коллагена и его распад. По остальным вопросам можно обратиться к соответствующей литературе — для стоматологов особо подчеркну, что в этих ваших инстраграмчиках и ютубчиках этого нет.
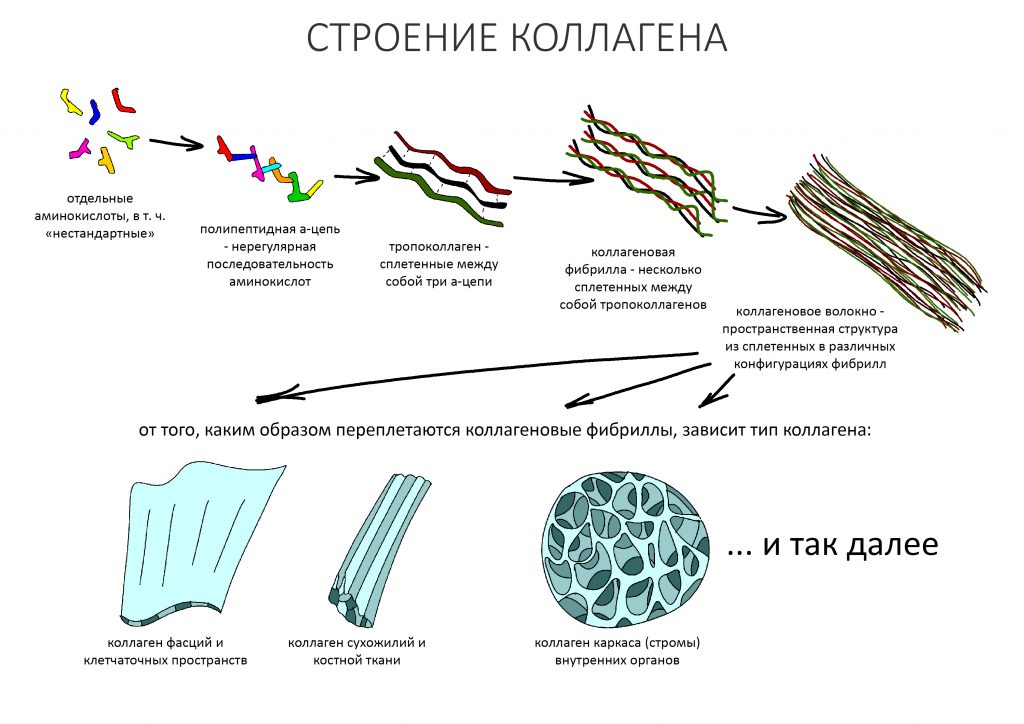
Коллаген представляет из себя пространственную нерегулярную структуру, состоящую из трех нитей аминокислот (а-цепей), скрученных в некое подобие веревки. Эта структура называется «тропоколлагеном», она весьма стабильна и существует за счет межмолекулярных водородных связей, формирующихся между некоторыми аминокислотами в a-цепях. Несколько тропоколлагенов склеиваются между собой за счет отдельных аминокислот и их специфических модификаций, формируя коллагеновую фибриллу. Фибриллы, в свою очередь, объединяются в коллагеновое волокно:
От того, каким образом происходит это объединение, получаются различные типы коллагенов. Нас интересует, в основном, коллаген I типа, в котором отдельные коллагеновые волокна похожи на многожильный сплетенный канат, что обуславливает их прочность и эластичность. Коллагеновые волокна соединяются в различные структуры, образуют связки, фасции, строму (каркас) внутренних органов и т. д.
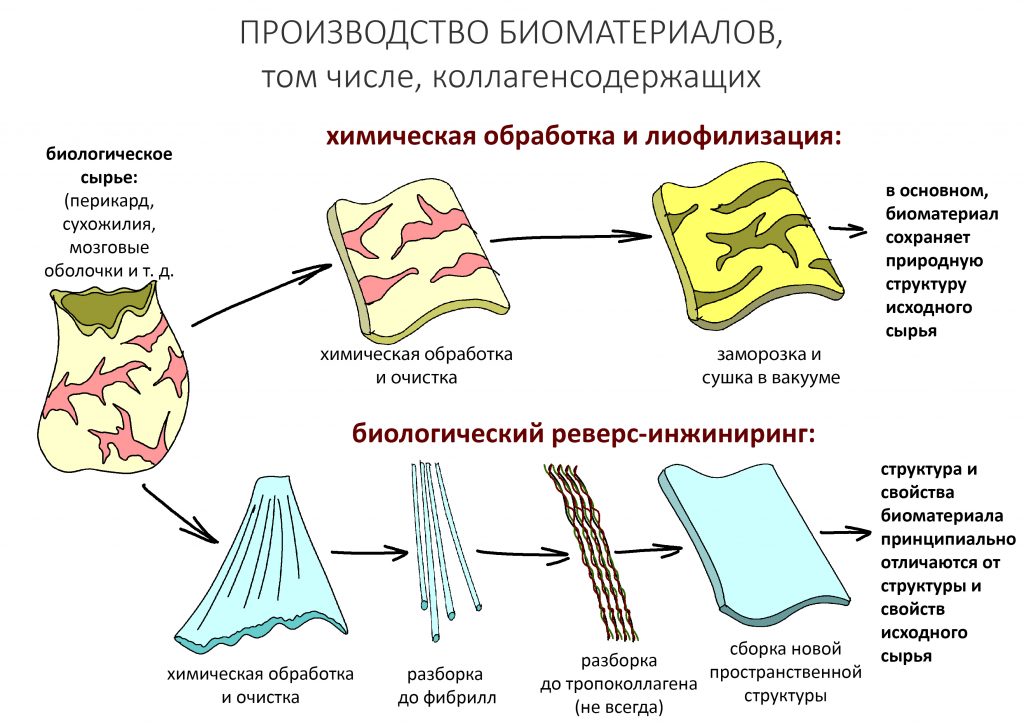
Почему это важно? Это важно для представления о технологиях производства биоматериалов. За исключением отдельных фриков, использующих лиофилизированные фрагменты алло- или ксенотканей (например, перикарда, пяточного жира, связок или твердой мозговой оболочки), большинство вменяемых производителей следуют такой схеме: взяли ткань, «разволокнили» её на отдельные коллагеновые волокна, затем — на отдельные фибриллы, из которых потом «собирается» новая барьерная мембрана или матрица. Ежу понятно, что сам производственный процесс, его параметры, ингредиенты и технологические этапы держатся в секрете, но суть везде одна и та же — реверс-инжиниринг природного синтеза коллагеновых волокон:
Поэтому когда вам рассказывают о «свинячьем» происхождении коллагена в мембране, матрице или графте, нужно знать, что от свиньи в них осталось чуть менее, чем ничего.
Понятливый Еж также напоминает, что именно такой способ производства (назовём его биологическим реверс-инжинирингом) гарантирует безопасность и биосовместимость используемых биоматериалов, в то время как технология лиофилизации целых фрагментов тканей…. ну, вы догадываетесь.
Замечу кстати, что производителей коллагеновых материалов в мире не так много — всего 4-5 фабрик, включая известную вам Geistlich Pharma. Большинство компаний, например Collagen Matrix, обслуживает пять-шесть брендов:

от того удивительнее то, что мембраны этих брендов имеют разную стоимость. Свободный рынок и высококонкурентная среда, епта!
Не менее интересной темой является распад коллагена. О нём стоит поговорить подробнее.
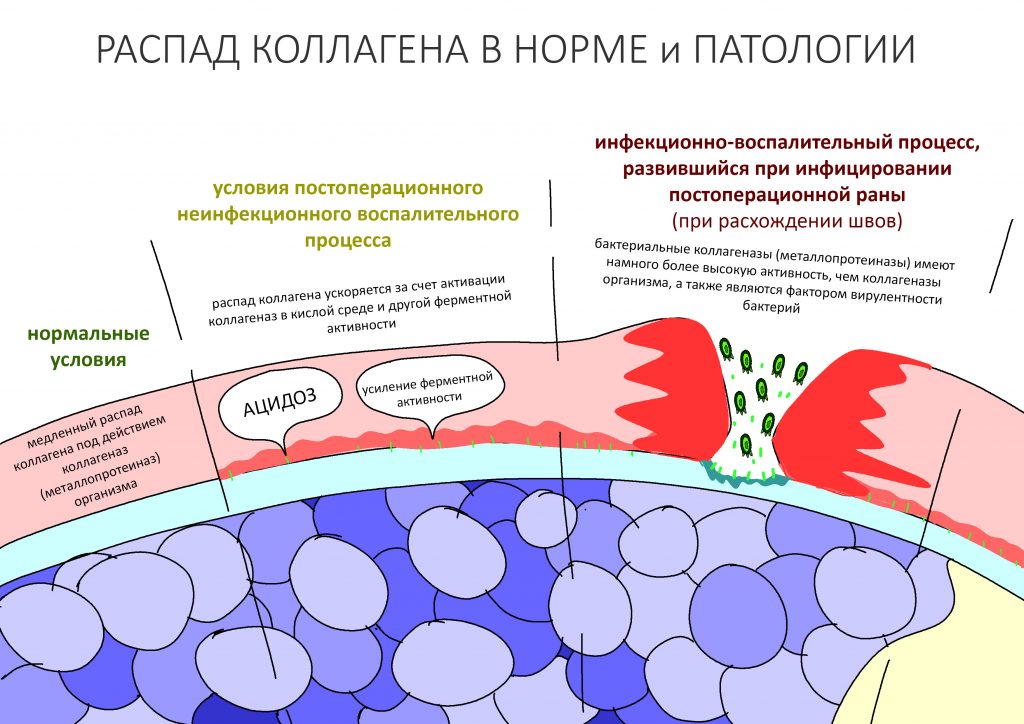
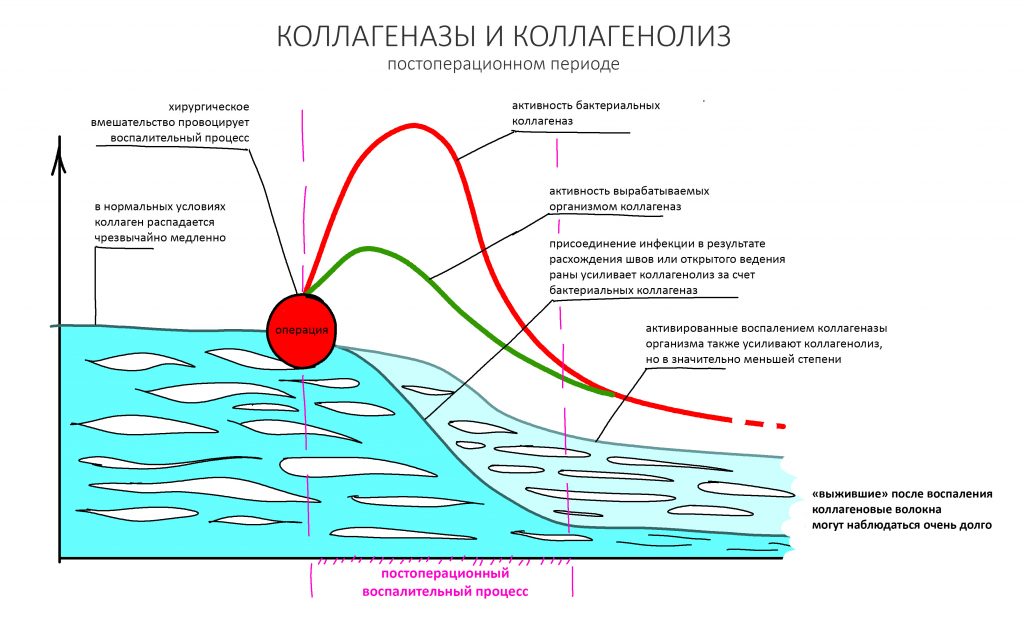
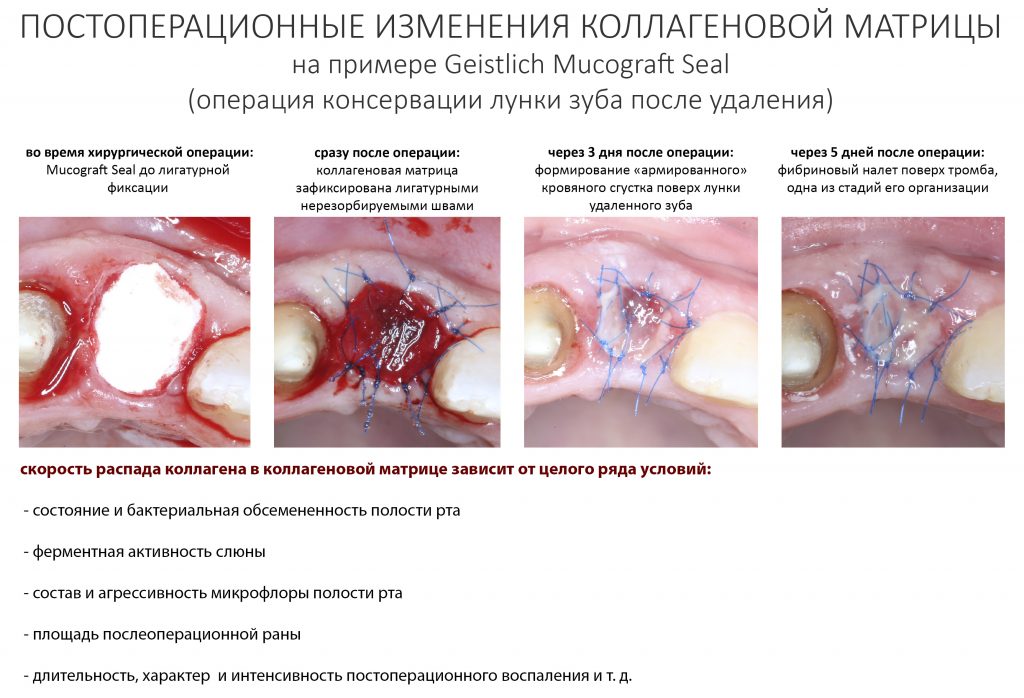
Коллагеназы (металлопротеиназы) — ключевые ферменты, участвующие в разложении коллагеновых волокон на составные части. Они вырабатываются как самим организмом, так и бактериями, живущими в полости рта. Для многих патогенных и условно-патогенных организмов коллагеназы являются основным фактором вирулентности, то есть способности вызывать заболевания. Кроме того, активность бактериальных коллагеназ весьма значительная — и это, кстати, объясняет, почему разошедшиеся над барьерной мембраной швы почти всегда приводят к её разрушению и неудачному результату остеопластики.
Важная ремарка: кто бы что ни говорил, но коллагеновые барьерные мембраны должны быть наглухо ушиты. Открывшаяся в полость рта барьерная мембрана - это почти всегда пиздец.
В нормальных условиях обмен коллагена идёт чрезвычайно медленно. При воспалении и в кислой среде активность вырабатываемых организмом коллагеназ значительно повышается, что ускоряет распад «стороннего» коллагена барьерных мембран и матриц — как раз этим объясняется их резорбция, исчезновение со временем. После стихания послеоперационного воспалительного процесса отдельные коллагеновые волокна, оставшиеся от использованных биоматериалов, могут определяться биохимическими и гистологическими методами чрезвычайно долго, вплоть до 10-12 месяцев.
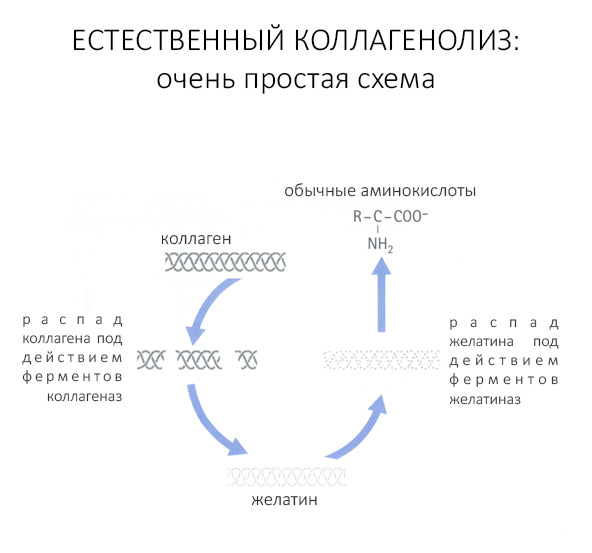
Естественный биологический распад коллагена можно описать следующей схемой:
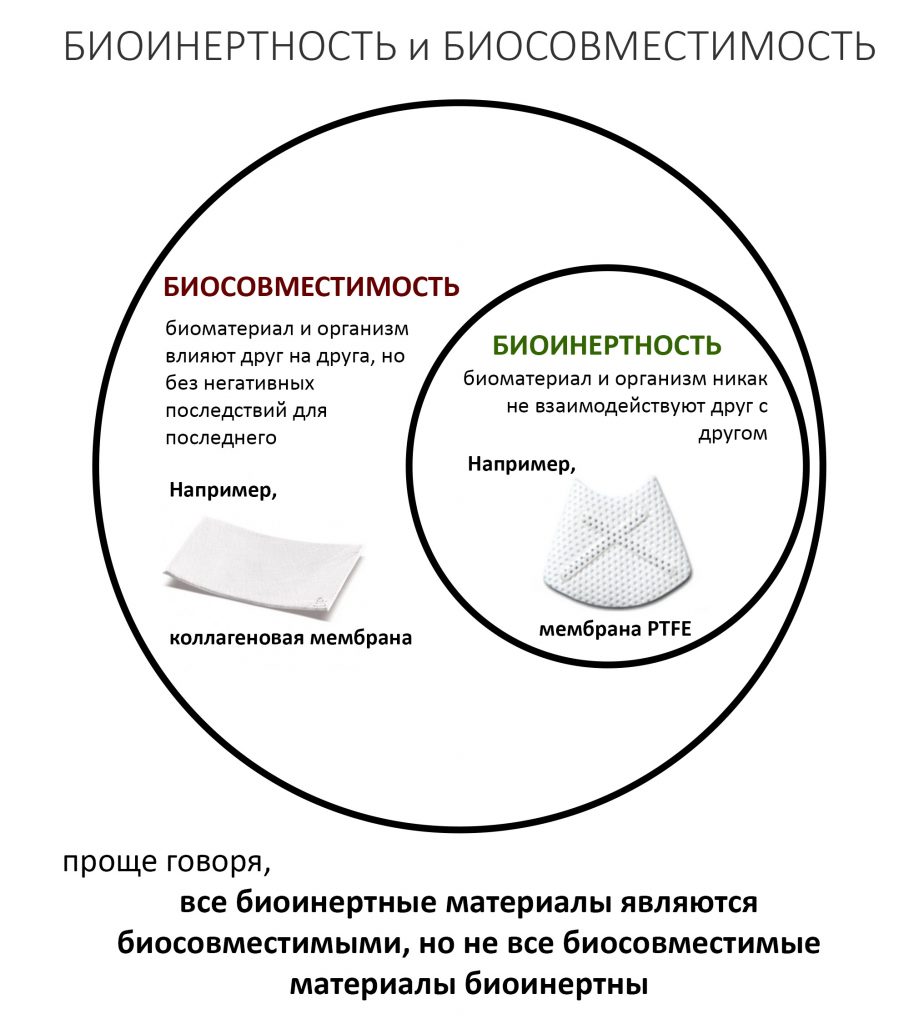
То, что коллаген прочный, эластичный и при этом весьма устойчивый к вырабатываемым ферментам белок, сделало его почти идеальным сырьем для производства биоматериалов. Однако, даже при идеальнейшей обработке он является биосовместимым, но ни в коем случае не биоинертным — и в это, на самом деле, очень важно:
Биоинертность подразумевает отсутствие взаимного влияния и взаимодействия организма. Типичный пример — это барьерная мембрана из политетрафторэтилена (PTFE, тефлона). В методе направленной костной регенерации она играет ту же самую роль, что и известные всем коллагеновые мембраны, однако не резорбируется и после использования извлекается в неизменном виде.
Биосовместимость предполагает взаимодействие биоматериала и организма, но без вредного воздействия на последний. Резорбция коллагеновой мембраны, коллагенсодержащего графта, полилактозного шовного материала (например, Викрила) и т. д. под воздействием ферментов и за счет фагоцитоза — это и есть то самое взаимодействие.
Коллагенсодержащие биоматериалы, в том числе матрицы и мембраны, разрушаются организмом при помощи вырабатываемых им коллагеназ, но в условиях отсутствия яркой тканевой реакции и влияния микрофлоры этот процесс растягивается на время, достаточное для начальной фазы регенерации костной ткани или десны. Собственно, в этом заключается главный принцип их использования.
В ходе этого процесса, меняются физические свойства и структура коллагеновых биоматериалов:
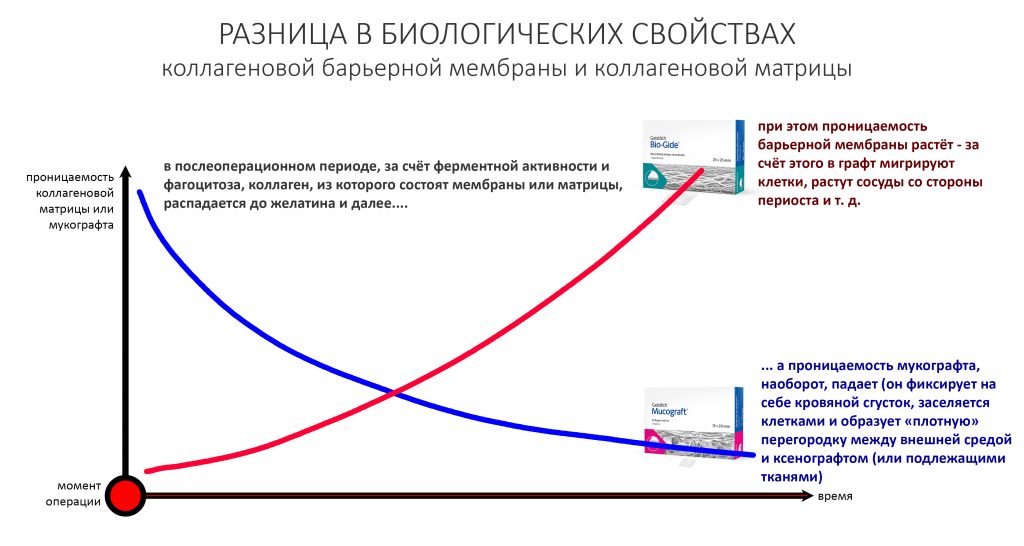
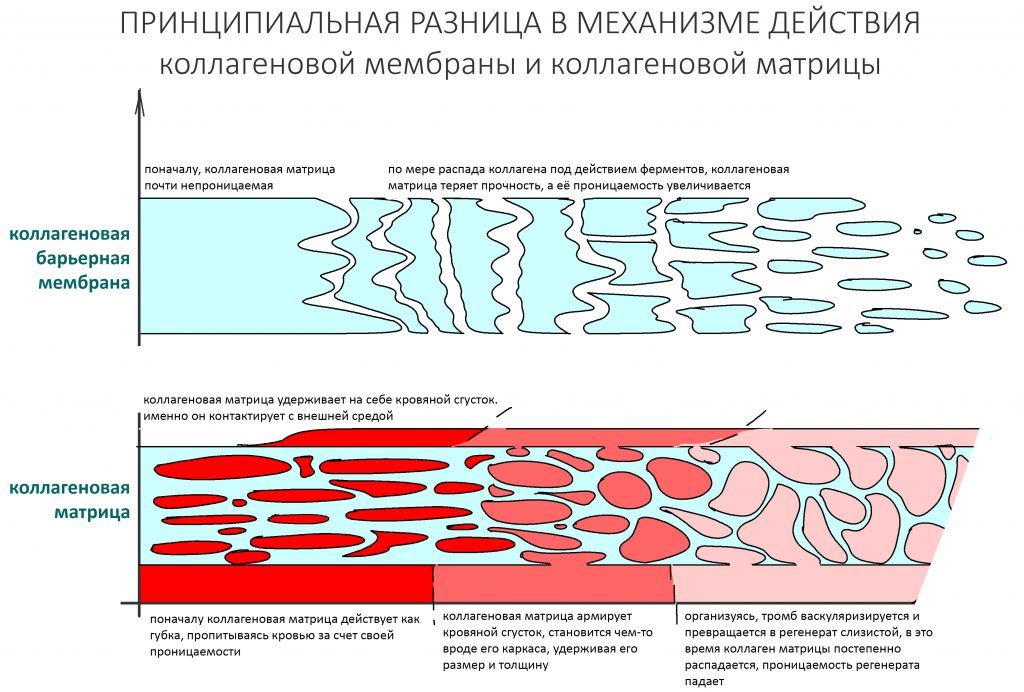
Несмотря на то, что в биоматериалах мы имеем дело с одним и тем же коллагеном и реакциями его распада, в барьерных мембранах и матрицах свойства меняются по-разному:
В этом есть некий диссонанс, не находите? После этой статьи я получил немало вопросов именно по этому графику — типа, с какого хрена я взял, что проницаемость матрицы падает, а мембраны увеличивается?
Объяснением служит разница в принципах действия мембран и матриц.
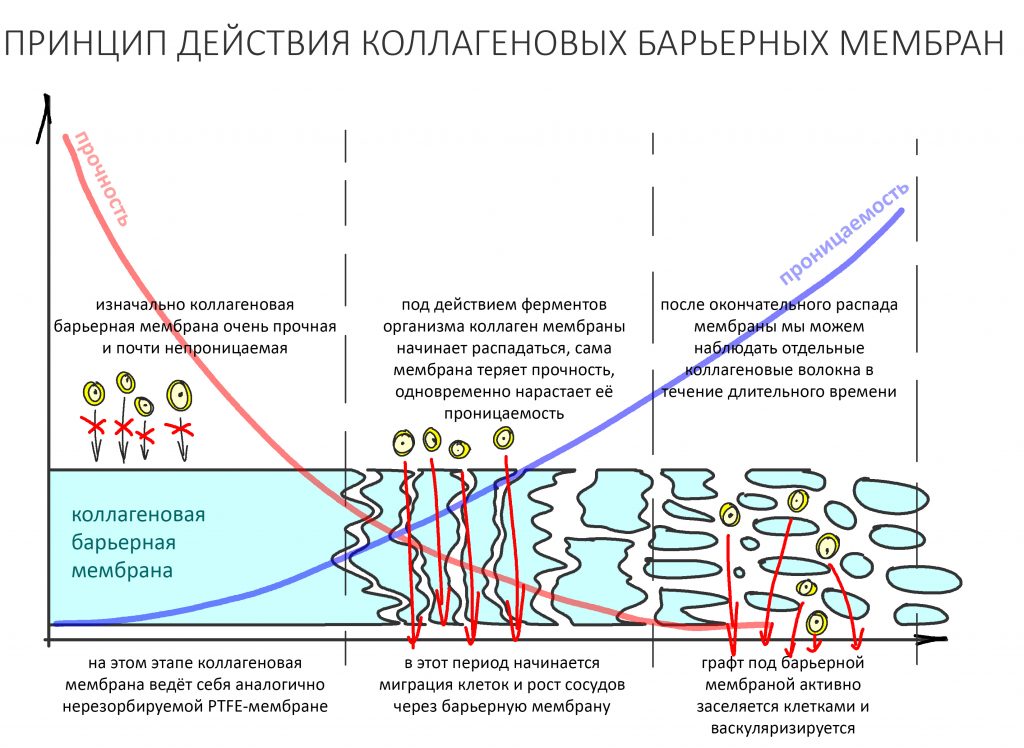
Лечебная эффективность барьерной мембраны основана на разделении тканей с разной скоростью регенерации — и здесь важную роль играет её непроницаемость и прочность.
С этой точки зрения, в первое время после операции остеопластики коллагеновая барьерная мембрана ничем не отличается от тефлоновой. Однако, со временем под действием коллагеназ она начинает распадаться — сначала на отдельные коллагеновые волокна, потом на фибриллы, затем превращается в желатин и т. д. На этом этапе падает её прочность и растет проницаемость. В рекламных буклетах вы наверняка видели красивые картинки с проросшими через мембрану сосудами и т. д. — так вот, это происходит не сразу после остеопластики, и не через несколько дней. Для того, чтобы мембрана стала проницаемой для растущих сосудов, необходимо, чтобы:
- активные коллагеназы, появившиеся в области операции во время постоперационного воспаления, «довели» барьерную мембрану до полупроницаемого состояния.
- закончились альтеративная и экссудативная фазы постоперационного воспаления, а оно само перешло в пролиферативную стадию.
Коллагеновая матрица работает иначе.
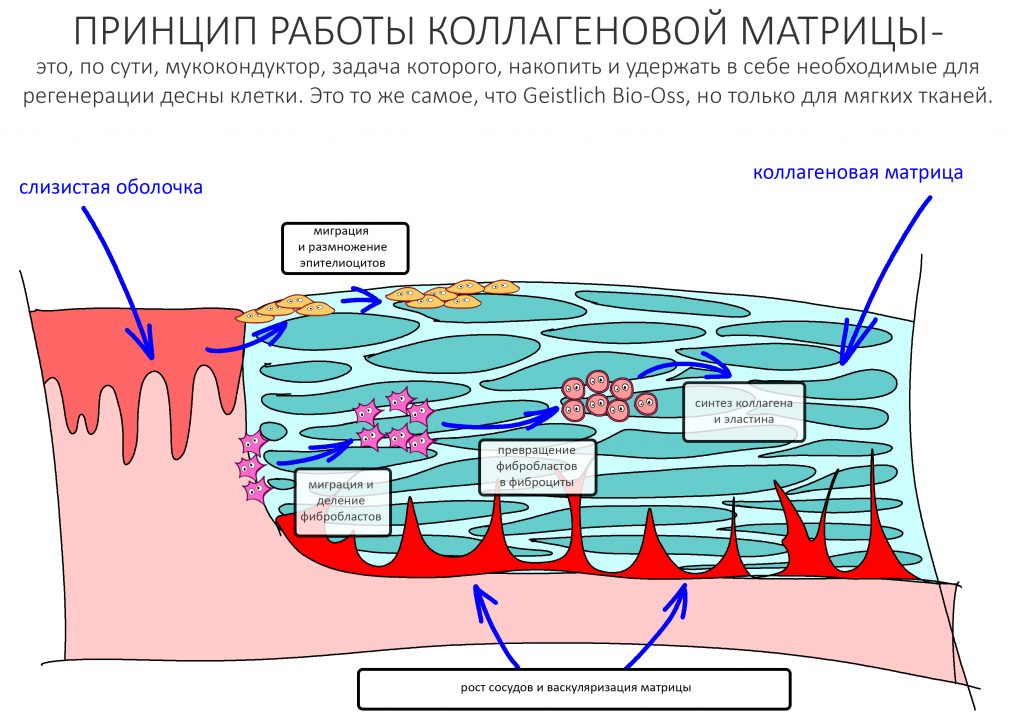
По принципу действия коллагеновая матрица является графтом. Её главная задача — накопить в себе побольше клеток, чтобы стать каркасом для будущей ткани. Для того, чтобы накопить клетки, она должна быть проницаема — иначе, как клетки в неё проникнут? Сразу после операции матрица заполняется клетками крови, в результате чего образуется что-то вроде «армированного» кровяного сгустка. Внутри него происходят те же самые процессы свёртывания крови, образования фибриновых нитей, ретракция и т. д., в результате чего получается армированный коллагеновыми волокнами тромб. Эффективность матрицы во многом будет определяться толщиной этого сформированного тромба, который в течение некоторого времени становится непроницаемым, набирает прочность, нём запускается гистогенез, ангиогенез и т. д. Строго говоря, то же самое происходит при любой травме, сопровождаемой повреждением тканей и сосудов — будь то кожа, слизистая и т. д. Коллагеновая матрица просто делает тромб более предсказуемым, стабильным и долгоживущим.
Именно поэтому коллагеновую матрицу Mucograft можно вести «в открытую», а барьерную мембрану — нет. Обсуждаемый в этой статье Fibro-Gide вести «в открытую» также нельзя, потому что… об этом будет в следующей части статьи.
Почему появилась необходимость в коллагеновых матрицах?
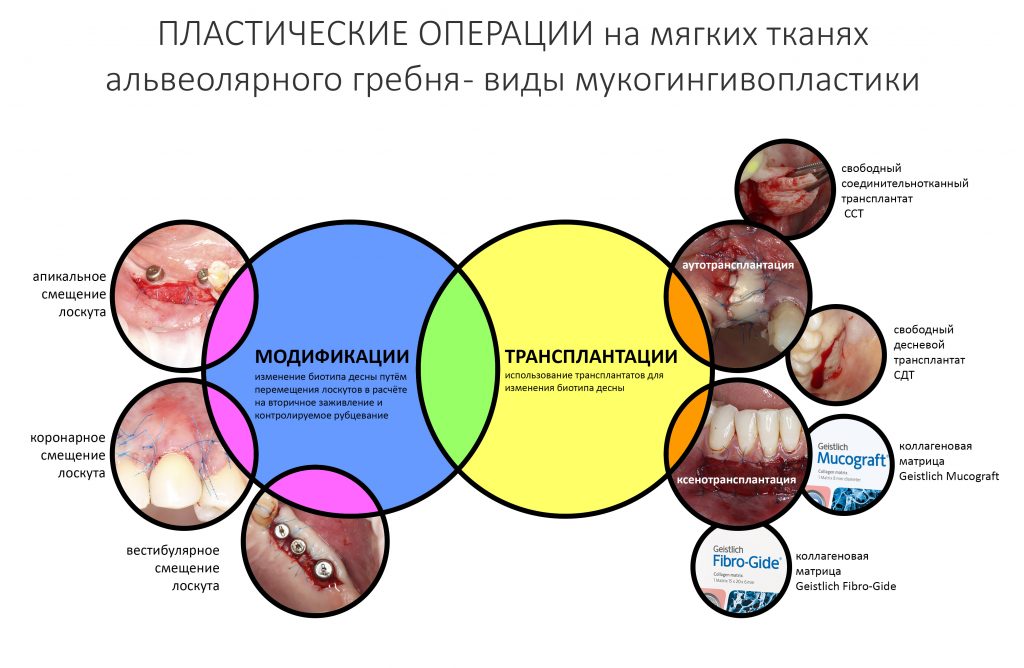
Об этом мы тоже говорили. Все существующие варианты пластических операций на десне мы можем свести к двум большим группам:
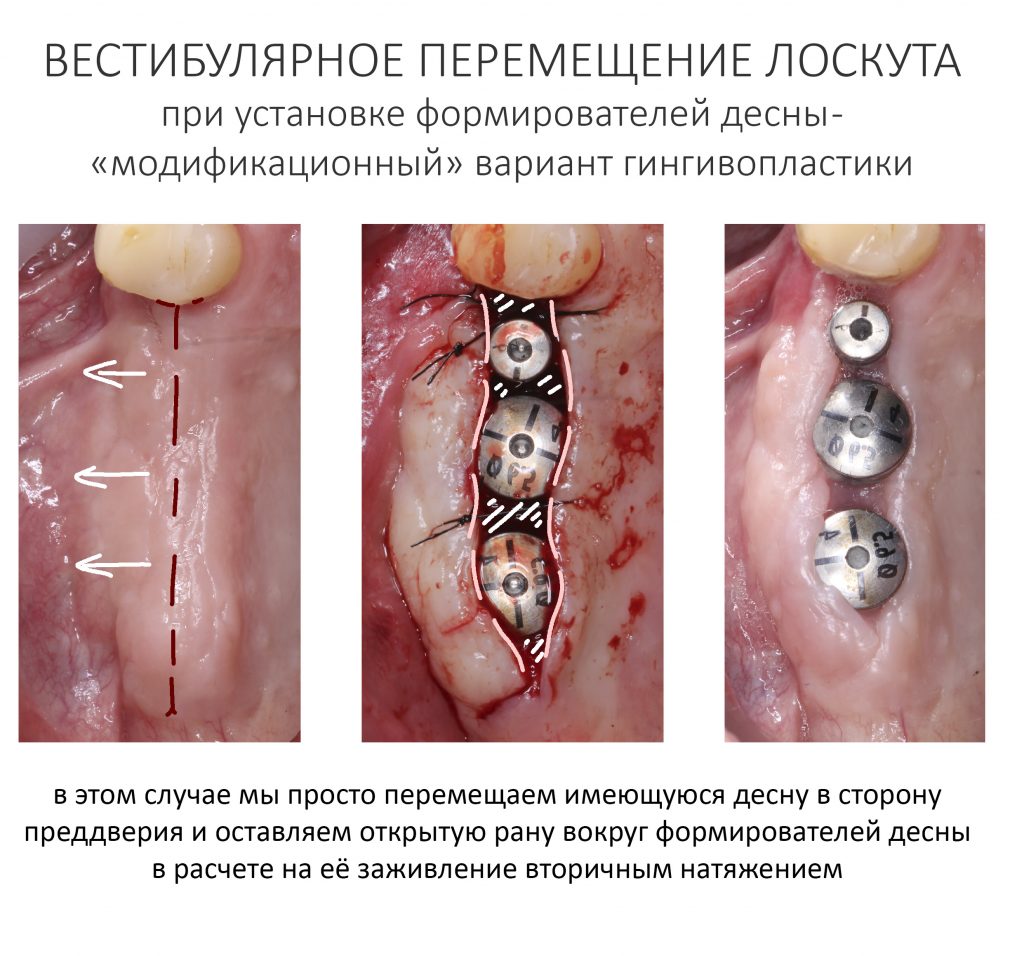
К модификациям относятся операции изменения геометрических параметров слизистой оболочки путём перемещения «местных» лоскутов. Иначе говоря, мы просто перетягиваем одни участки десны на место других, кроим и вышиваем — а далее надеемся, что всё это нормально заживёт и образует нужный нам результат. Примерном таких операций может быть вестибулярное смещение лоскута при установке формирователей десны, вестибулопластика с открытой раной, краевая гингивотомия и т. д. В основной своей массе, методы модификации не требуют использования биоматериалов.
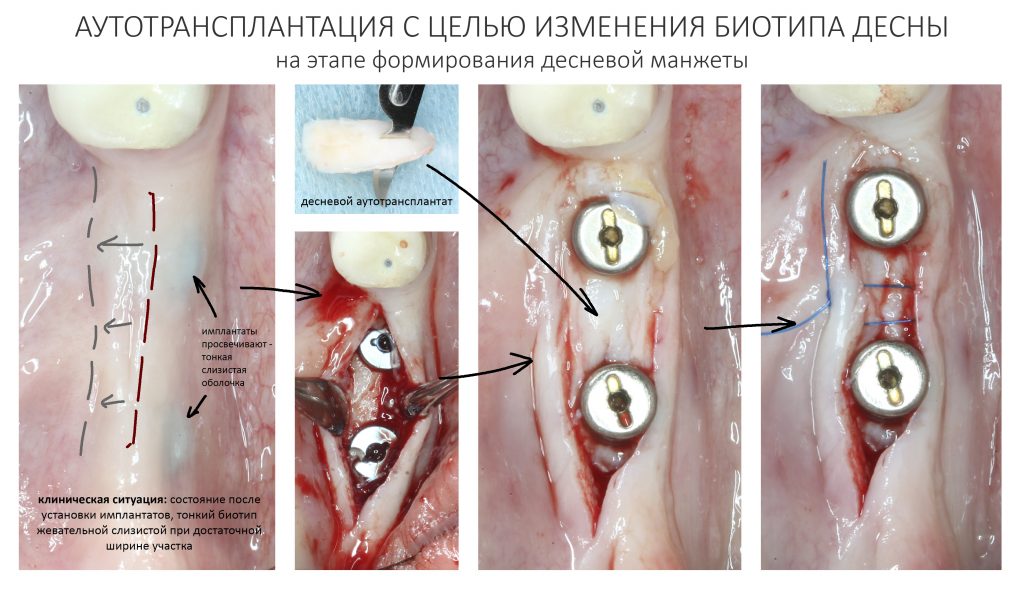
Второй группой методов гингивопластических операций являются трансплантации. Необходимость в трансплантациях возникает в тех клинических случаях, где мы сталкиваемся с существенным дефицитом какого-либо параметра десны, либо с невозможностью решения клинической задачи путём модификации. В таких ситуациях мы используем трансплантат, который нужно откуда-то взять.
Причём, сам трансплантат по своим свойствам должен более-менее соответствовать тому участку десны, куда он перемещается, в противном случае он не решит поставленных нами клинических задач: нельзя восполнять дефекты жевательной десны с помощью выстилающей слизистой оболочки и наоборот, хотя всем известны не только попытки, но и отработанные методики реконструкции тканей полости рта с помощью кожных или подкожных трансплантатов — вспомнить хотя бы филатовский стебель и все прочие шагающие лоскуты на ножке. Результаты такого лечения являются следствием безвыходности и серьезных компромиссов, которые в дентальной имплантологии недопустимы. Поэтому мы возьмём за правило, что если мы собираемся восстановить оперировать жевательную десну, то и трансплантат у нас тоже должен быть из жевательной десны. Это важно.
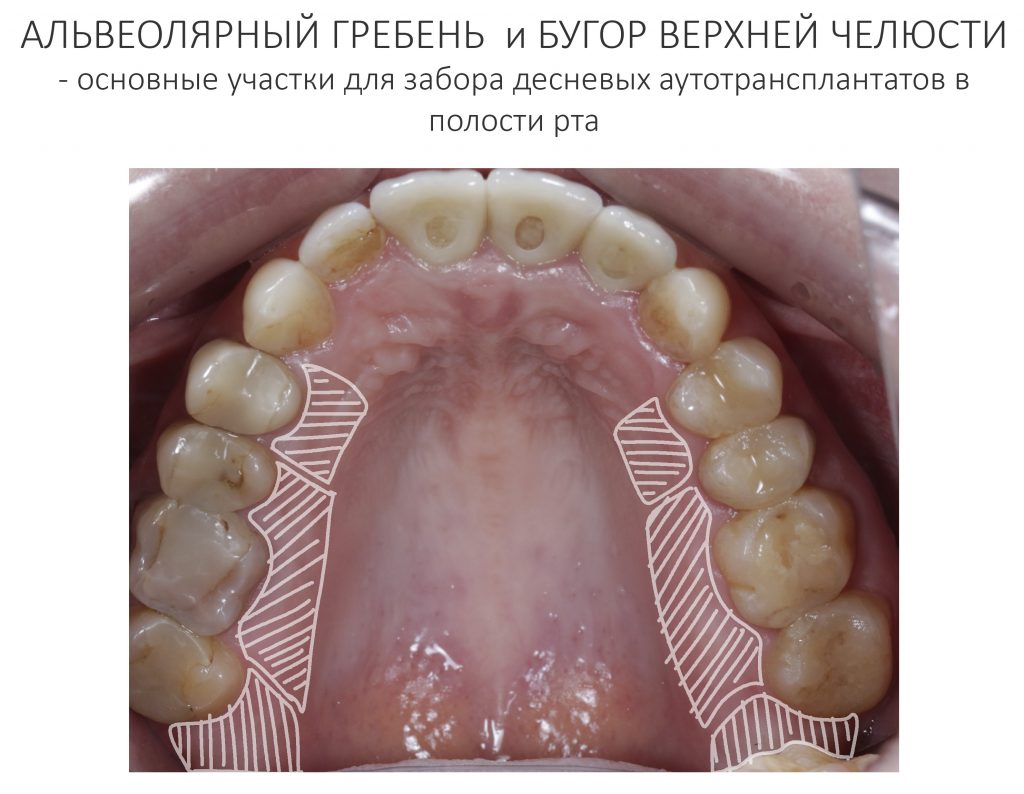
Так вот, ключевая проблема гингивопластик-трансплантаций состоит в том, что донорских участков для получения необходимых по размеру и свойствам трансплантатов у нас не так много.
Кроме того, забор десневого трансплантата оставляет в полости рта рану, которую сложно ушить, которая находится в очень чувствительном месте и за которой весьма сложно ухаживать. Я уже не говорю о том, что с донорским участком связан основной дискомфорт и большинство осложнений после гингивопластических операций — за примерами далеко ходить не нужно. При этом мы существенно ограничены в объемах получения трансплантатов, а у людей с «тонким» биотипом слизистой оболочки получить трансплантат для изменения толщины десны вообще невозможно.
Все эти проблемы были выявлены не вчера, они известны всем и очень хорошо изучены. Работа над их решением шла в разных направлениях: были попытки использовать дермальные трансплантаты, экспандеры, тефлоновые пленки и т. д. Но дальше всех в этом продвинулась компания Geistlich Pharma, предложив использовать для восполнения дефектов слизистой оболочки ксенотрансплантаты — по аналогии с ксенографтами для кости.
Мы уже писали коллагеновой матрице Mucograft и особенностях её применения в клинических ситуациях, связанных с увеличением ширины участка жевательной десны. Я был одним из первых докторов в России, кто использовал Mucograft в своей практике, а сейчас наша Уютная КЛИНИКА ИН не только широко использует все виды коллагеновых матриц, но еще обучает других докторов обращению с ними.
Появление Fibro-Gide, коллагеновой матрицы, предназначенной для «утолщения» слизистой оболочки полости рта, было лишь вопросом времени, поскольку потребность в этом биоматериале не просто большая, а огромная. Как я уже отметил выше, мы используем Fibro-Gide с 2018 года, и сейчас две трети гингивопластических операций, связанных с увеличением толщины десны в области имплантатов проводятся с использованием этого биоматериала. Проблемы постоперационного периода, связанные с донорским участком, ушли в прошлое. Ну, или почти ушли.
Как это работает?
Я не зря указал на аналогию с графтами для кости, потому как принцип действия коллагеновых матриц очень похож на таковой у костных ксенотрансплантатов. В чем состоит лечебный эффект последних — известно всем. Так вот, коллагеновые матрицы работают точно также:
С этой точки зрения, коллагеновая матрица похожа на всем известный Bio-Oss с тем лишь отличием, что состоит из не из минерального вещества, а из коллагена. Последний, как мы уже обсуждали выше, подвержен действию коллагеназ, поэтому со временем резорбируется, причём скорость резорбции не поддаётся сколько-нибудь точной оценке, в каждом клиническом случае она будет индивидуальной. Можно предположить, что на неё влияет ряд факторов:
но если кратко, то чем дольше и интенсивнее протекает постоперационное воспаление, чем хуже гигиена полости рта (во рту больше микробов) — тем быстрее происходит разрушение коллагена в матрице, тем быстрее она теряет свои свойства. Как и в случае с минеральным ксенографтом, для достижения наилучшего результата лечения нам нужно, чтобы коллагеновая матрица сохраняла свою структуру как можно дольше — вот почему для проведения гингивопластических операций важны как хороший уровень гигиены полости рта, так и грамотное постоперационное ведение пациента. В противном случае, вместо результата лечения мы получаем какую-то фигню и навсегда теряем интерес к биоматериалам.
Продолжение следует…
В следующей части статьи мы обсудим показания и противопоказания к использованию коллагеновых матриц, подготовку и проведение хирургического вмешательства (изменения толщины слизистой оболочки в области имплантатов), постоперационное ведение и возможные ошибки и осложнения. Рекомендую подписаться на наш сайт или страницы в социальных сетях, чтобы не пропустить всё самое интересное.
С уважением, Станислав Васильев,
имплантолог, уютная КЛИНИКА ИН.