Направленная костная регенерация, более известная по сокращению «НКР» или заграничному GBR (Guided Bone Regeneration) — одна из самых популярных методик наращивания костной ткани перед имплантацией. Её популярность объясняется несколькими факторами, между прочим, никак не связанными с её эффективностью и результативностью:
— НКР не требует дорогостоящего оборудования. По сути, для её проведения достаточно минимума инструментов.
— Использование биоматериалов позволяет стоматологам зарабатывать на их продаже.
— Интуитивно понятная технология по принципу «насыпал-закрыл-зашил».
Наконец, благодаря компании Geistlich Pharma, которую я совершенно заслуженно называю первой в биоматериалах, в нашей стране широко известен Иштван Урбан со своими «сосисками». Он, хоть и не является изобретателем методики, сделал немало для популяризации НКР среди моих коллег. В интернетах регулярно появляются объявления о гастролях его учеников, пересказывающих Урбана за деньги тем, кто из-за нищебродства не может учиться у него лично. Ежу понятно, что методика преподносится как универсальная, о связанных с ней проблемах никто не говорит и не пишет. Как в Гербалайфе: «Научи меня, я буду учить других.»
Думаю, мне стоит обозначить свою позицию прежде, чем я продолжу рассказ об этом методе остеопластики. У меня нет негативного отношения ни к НКР, ни к Урбану лично. Эффективность направленной костной регенерации не выше и не ниже, чем у других способов костной аугментации, при сопоставимом уровне неудач и осложнений. Возможно, в своей практике мы используем её чуть реже, чем другие методы наращивания костной ткани, но это связано исключительно с её стоимостью — в конце концов, есть сравнимые по результативности методы, но проще и дешевле. Однако, я не могу не замечать чрезмерного упрощения НКР, возведения её в ранг безальтернативной и универсальной методики, расширения показаний и игнорирования ограничений, которые её сопровождают.
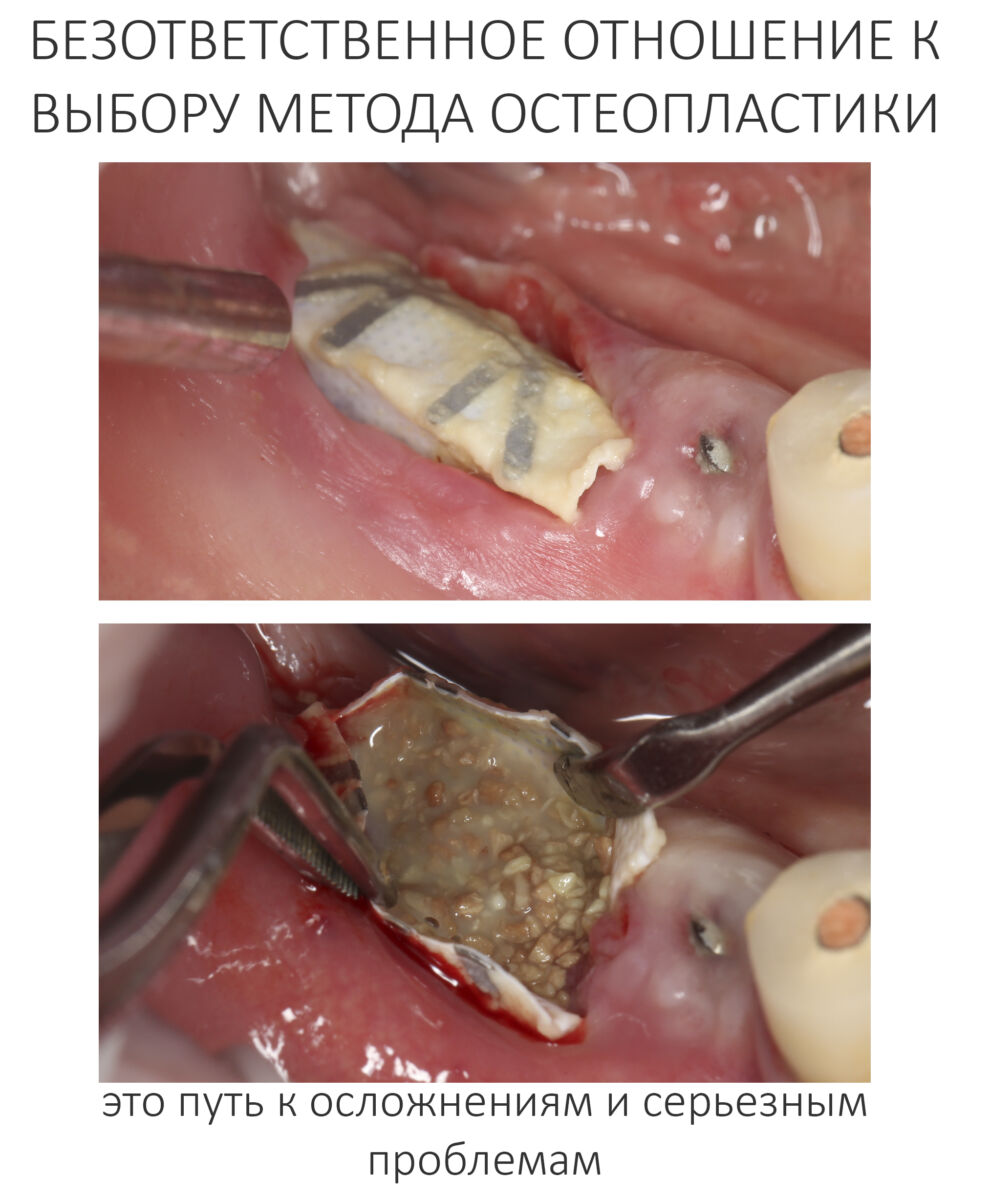
«Да чо там делать-то?» — пишет мне доктор, — «Настругал стружки, намешал бИоса, закрыл, прикрутил — и всё на этом!», а через несколько недель его пациент с резко ухудшившейся клинической ситуацией попадает ко мне, вынуждая меня ломать голову, как решить эту проблему.
Переделки — это плохо, и я не могу сказать, что мы всегда достойно выходим из ситуации. Поэтому лучше не доводить пациента до переделок.
Наперво, я рекомендую вернуться к тому, что уже написано по этому поводу:
Методы остеопластики: остеотомия и расщепление альвеолярного гребня
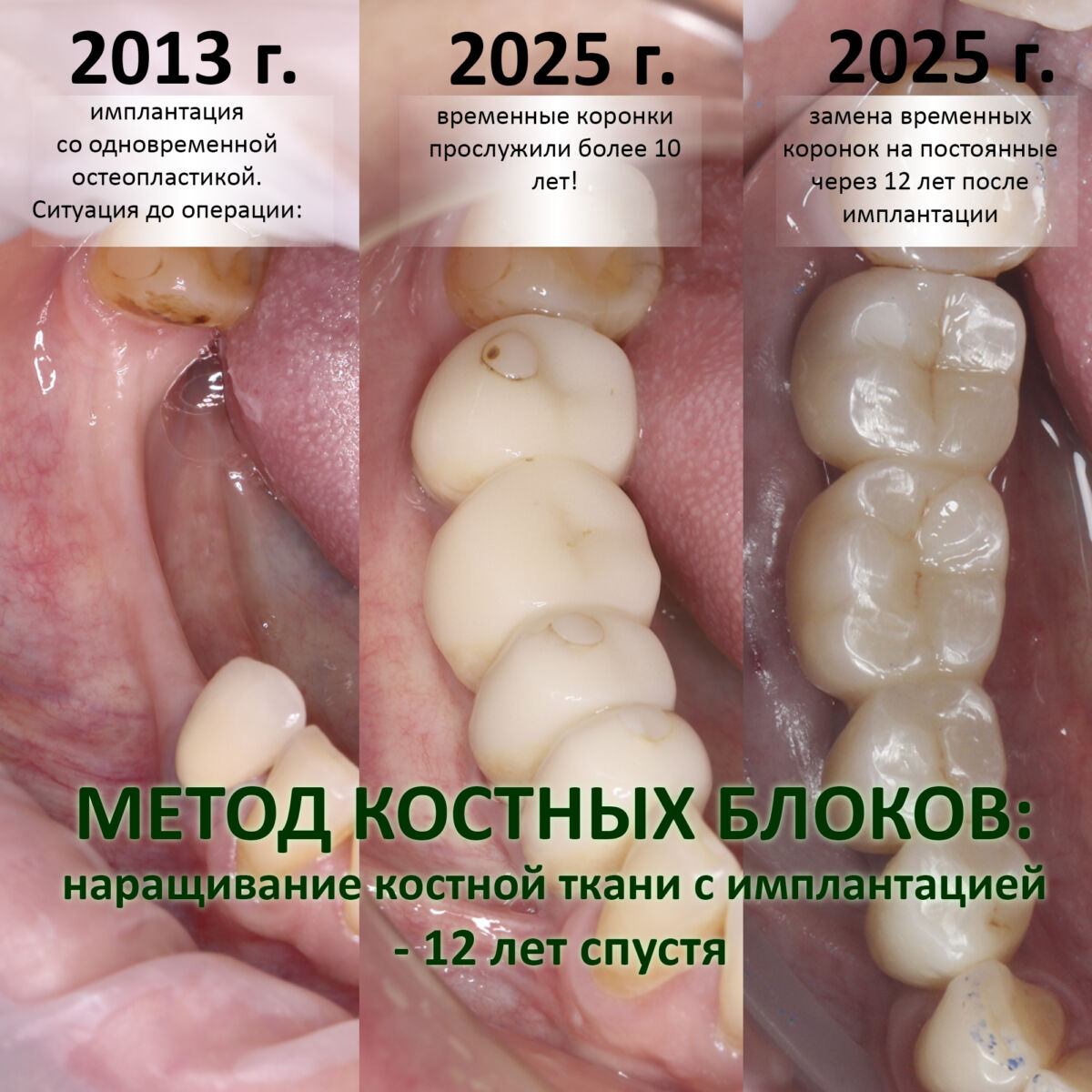
Методы остеопластики: аутотрансплантация (пересадка) крупных костных фрагментов
Имплантация с одновременным наращиванием костной ткани: планирование и принятие решений
Имплантация с одновременным наращиванием костной ткани: алгоритм, результаты, проблемы
Это большие профессиональные статьи для врачей. Для пациентов есть целый цикл об остеопластике, состоящий из пяти публикаций — я настоятельно рекомендую прочитать его всем, кому предстоит подобная процедура.
В дополнение — все публикации с меткой остеопластика и мой персональный сайт www.implant-in.com. Вряд ли кто-то написал о наращивании костной ткани больше меня, и вы можете всем этим пользоваться, причем совершенно бесплатно.
Суть метода НКР
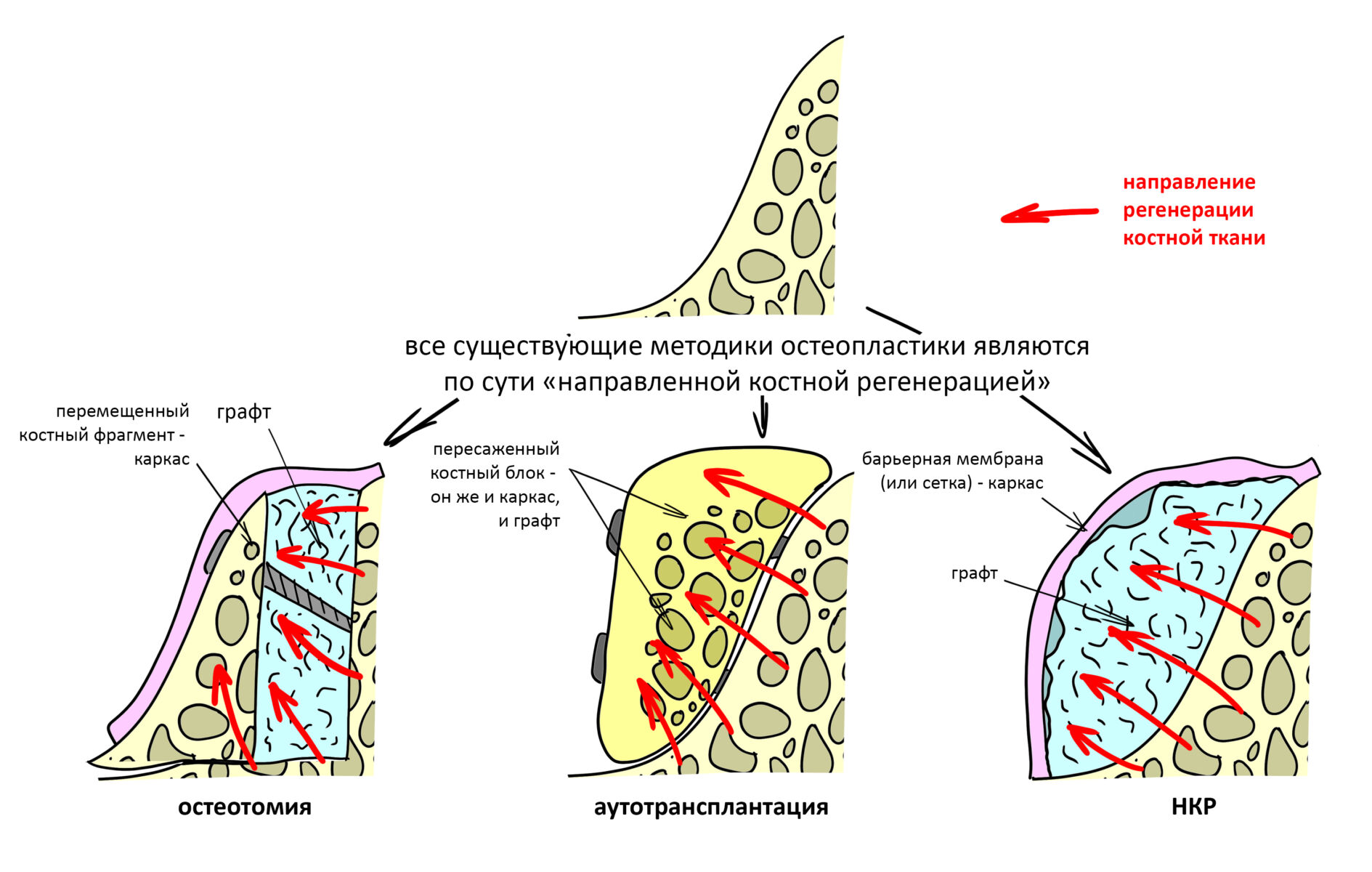
Строго говоря, любой из методов наращивания костной ткани можно назвать направленной костной регенерацией, поскольку с помощью биоматериалов, перемещения или пересадки костных фрагментов, мы направляем регенерацию костной ткани туда, куда нам нужно. Однако, название «НКР» закрепилось именно за описываемой ниже методикой.
В древней статье «Теория остеопластики» я описал основные принципы наращивания костной ткани:
— создание каркаса для будущего регенерата
— удержание каркаса на время, необходимое для регенерации костной ткани
Достичь этого мы можем разными способами: так, в методе аутотрансплантации сам пересаженный костный блок является и каркасом, и графтом, а при остеотомии каркасом является перемещенные фрагменты альвеолярного гребня, удерживаемые фиксирующими металлоконструкциями или винтами. В случае НКР всё немного иначе: барьерная мембрана создает каркас, но удерживается он… графтом. Поэтому свойствам используемых биоматериалов в методе направленной костной регенерации всегда уделяется максимум внимания. О материалах мы поговорим чуть позже, а пока разберем принцип действия этой методики.
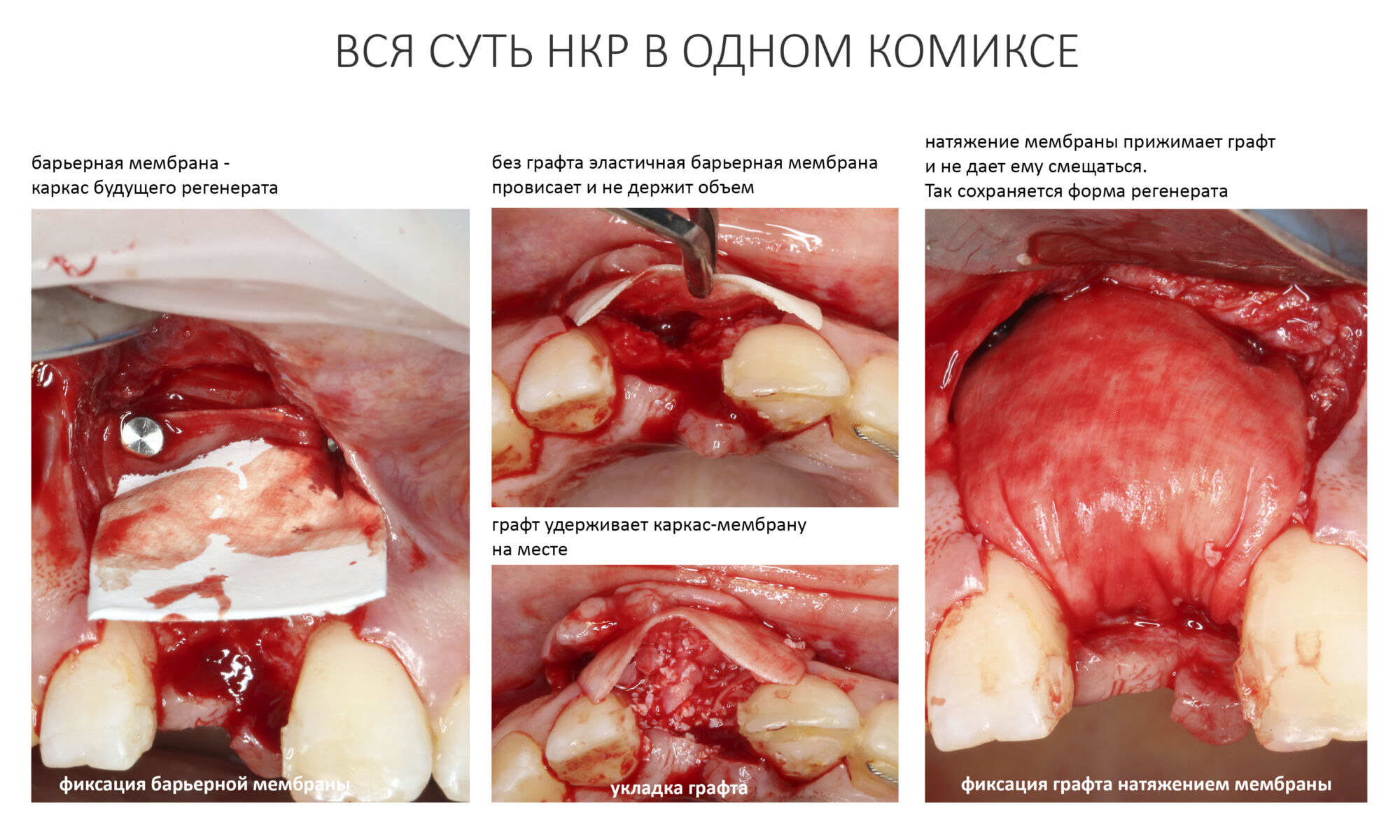
Итак, в ходе операции мы восполняем утраченный объем костной ткани с помощью графта, который неподвижно фиксируем на поверхности костной ткани путем прижатия барьерной мембраной:
Давно известно, что иммобилизация графта является важным фактором успеха любой остеопластической операции. Если графт останется подвижным, результат операции будет утрачен. Каким образом происходит иммобилизация графта при проведении НКР, лучше всего демонстрирует простой домашний эксперимент: возьмите пакет с какой-нибудь крупой, положите на стол, надавите на него рукой. крупа в пакете изменит свою форму. Но если скрутить пакет так, чтобы крупа оказалась под давлением, то раздавить её будет не так просто.
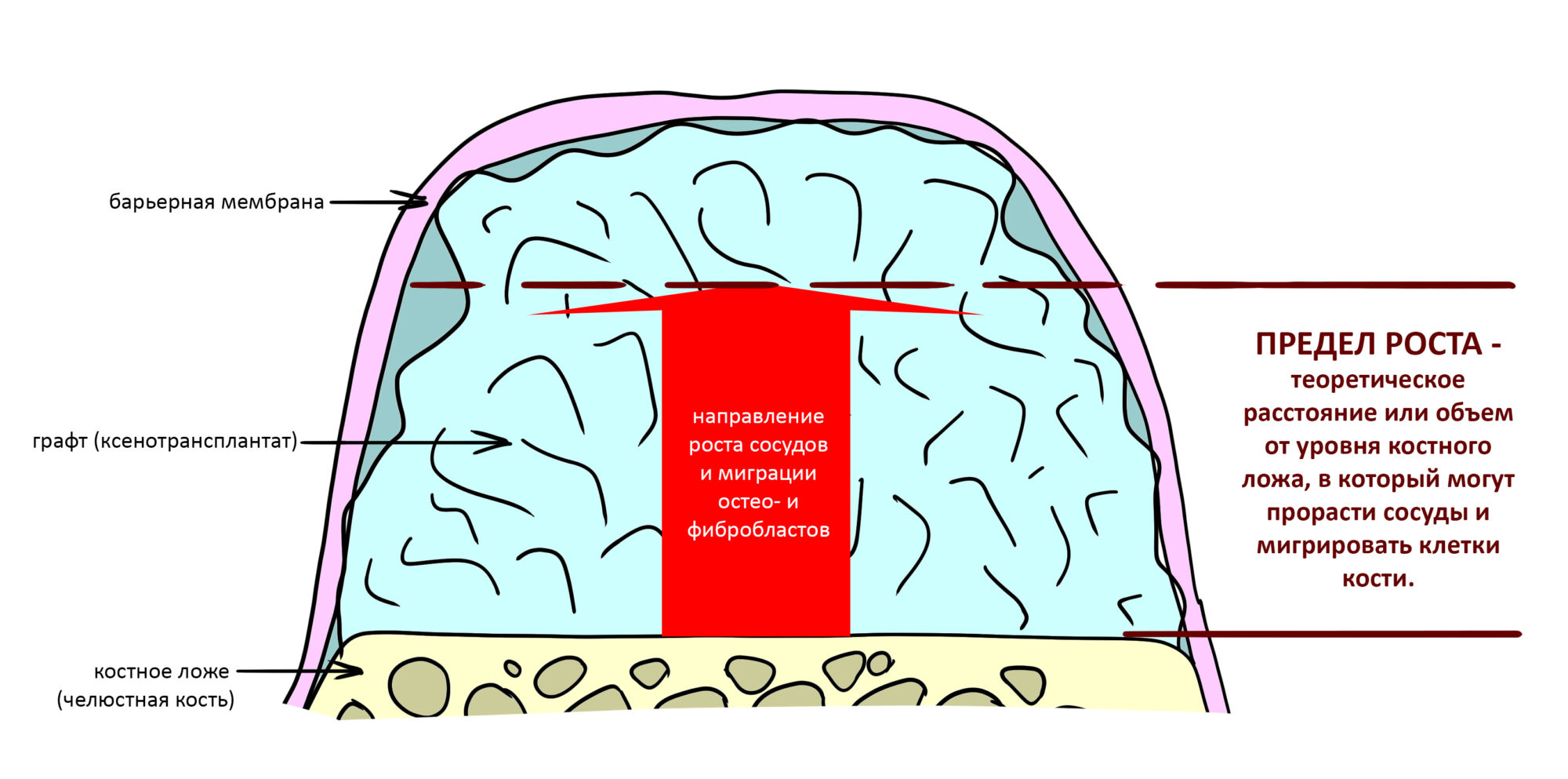
Так вот, полиэтиленовый пакет — это барьерная мембрана, а крупа — это ксенографт, которым замещается утраченный объем кости. Если графт не будет прижат мембраной, то восполненный объем не получится удержать на месте. Но если графт зафиксирован правильно и барьерная мембрана неподвижно удерживает его на месте, то объем наращиваемой костной ткани будет ограничен только пределом роста, индивидуальным для каждой клинической ситуации.
Кстати, именно наличием предела роста объясняется, почему наращивание больших (свыше 10 мм в линейных размерах) объемов костной ткани с помощью НКР представляет значительные сложности, в то время как восстановление 1-2 мм стало обычным и заурядным делом. Есть способы увеличения предела роста, они довольно просты, но… вернемся к нашим баранам, то есть к разбору того, как НКР работает.
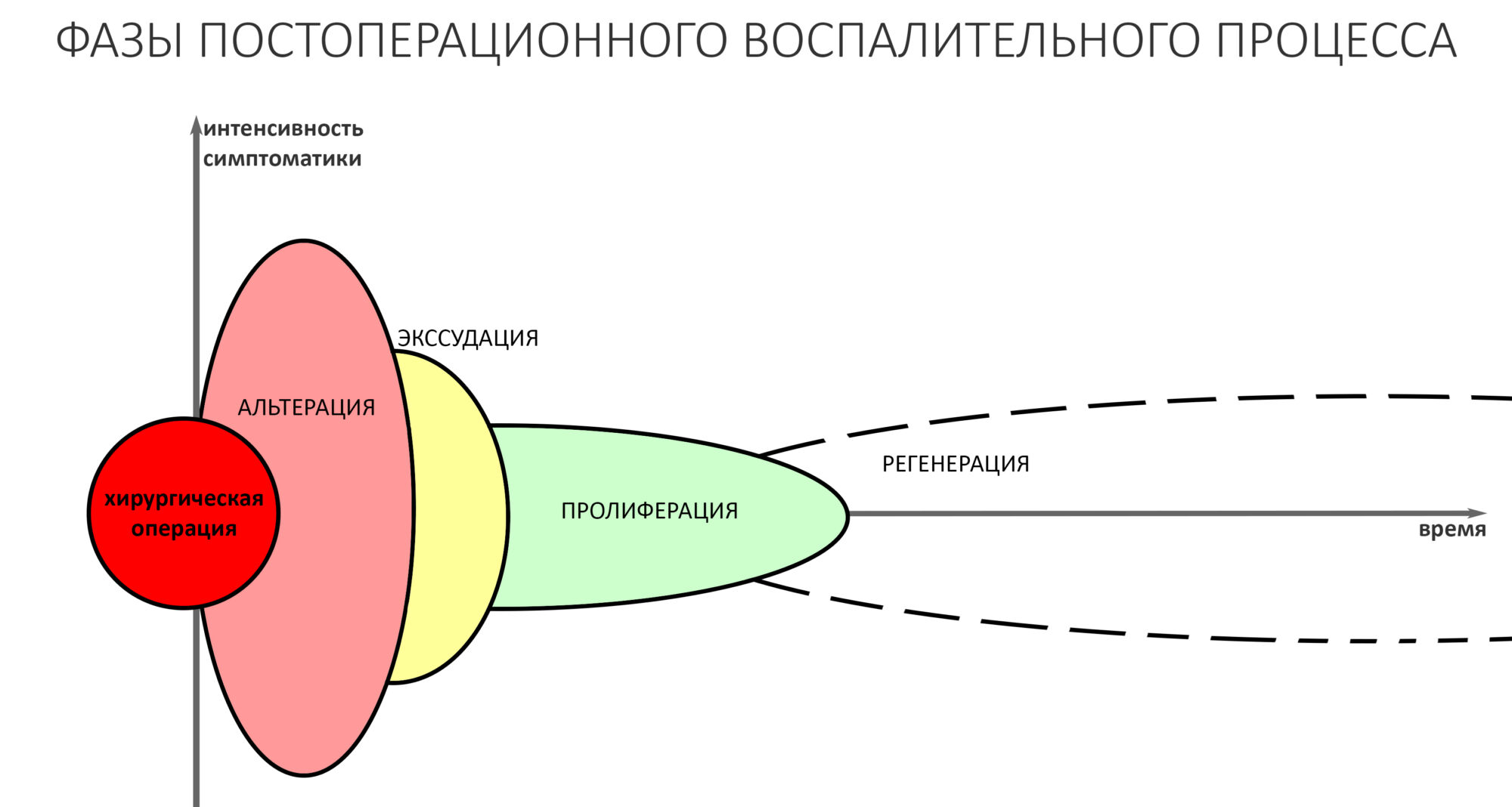
Итак, имеется дефект костной ткани челюсти, который мы расковыряли, заполнили графтом и перекрыли барьерной мембраной — и всё это назвали «остеопластической операцией». За любой операцией, которую организм воспринимает как жестокую травму, следует постоперационное воспаление. Известно, что оно состоит из трех фаз, альтерации, экссудации и пролиферации.
Постоперационное воспаление — это стартер всего регенеративного процесса. Если не будет воспаления — не будет и регенерации. Поэтому активное подавление воспаление и борьба с постоперационной симптоматикой уколами дексаметазона (альтернативно одаренные делают инъекции прямо в область операции) приводит к негативным последствиям, вплоть до полной утраты результата остеопластики.
В нормальных условиях (без стимуляторов) альтерация протекает по границе дефекта, а мишенью макрофагов, помимо попавших в рану бактерий, являются поврежденные в ходе операции фрагменты тканей и клеток. Интересно то, что восстанавливаются именно те ткани, которые разрушались, т. е. регенерация управляется факторами роста, получаемыми в процессе разрушения и последующего «переваривания» тканей фагоцитирующими клетками. Зная это, мы стремимся получить больше факторов роста кости, т. н. «белков костного морфогенеза» (БКМ) или BMP (bone morphogenetic proteins), если писать английскими фломастерами.
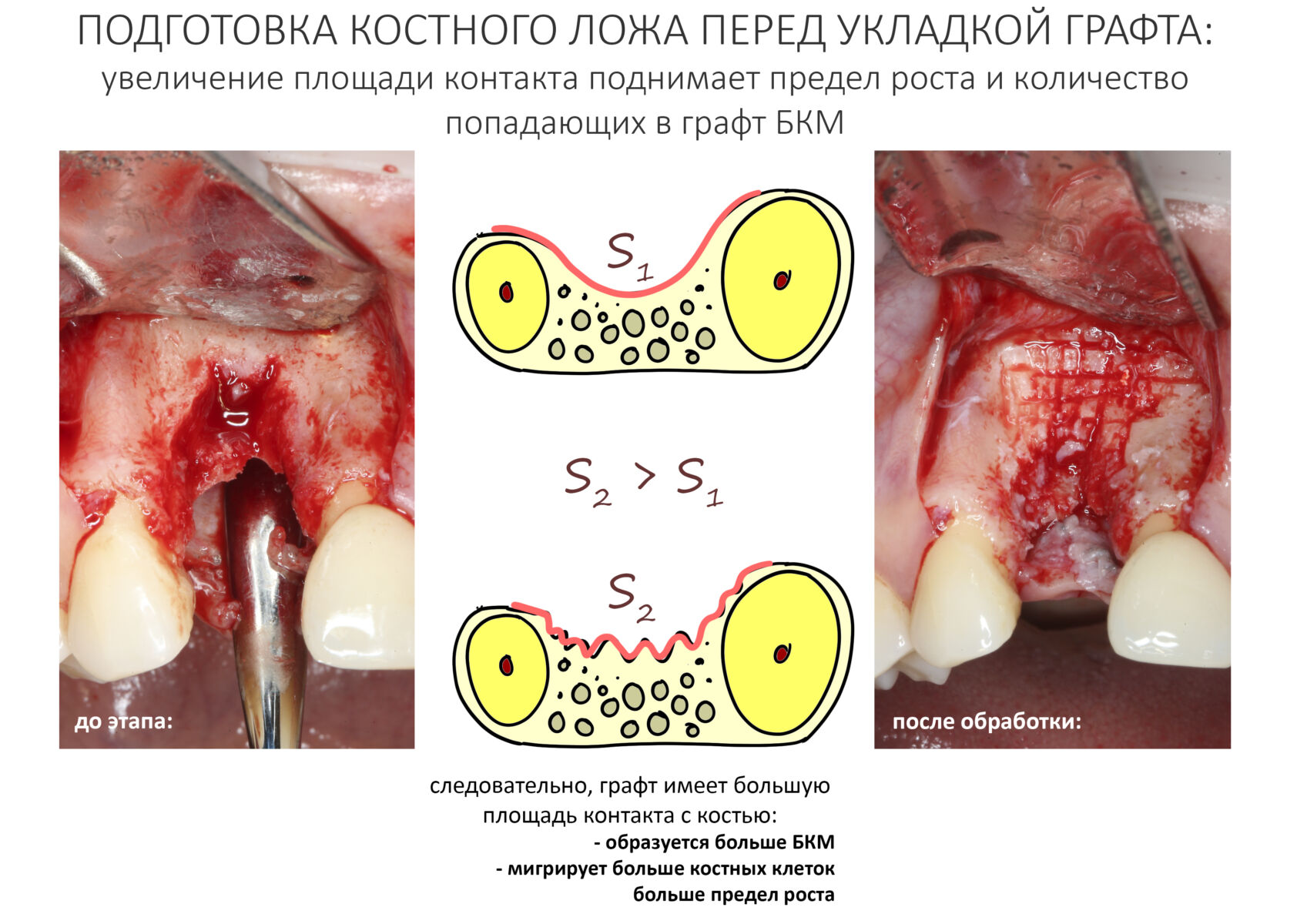
Получение БКМ с поверхности костного дефекта ограничено, этим объясняется существование уже упомянутого «предела роста». Можно увеличить площадь поверхности за счет её обработки, создания насечек и т. д., но это не всегда возможно.
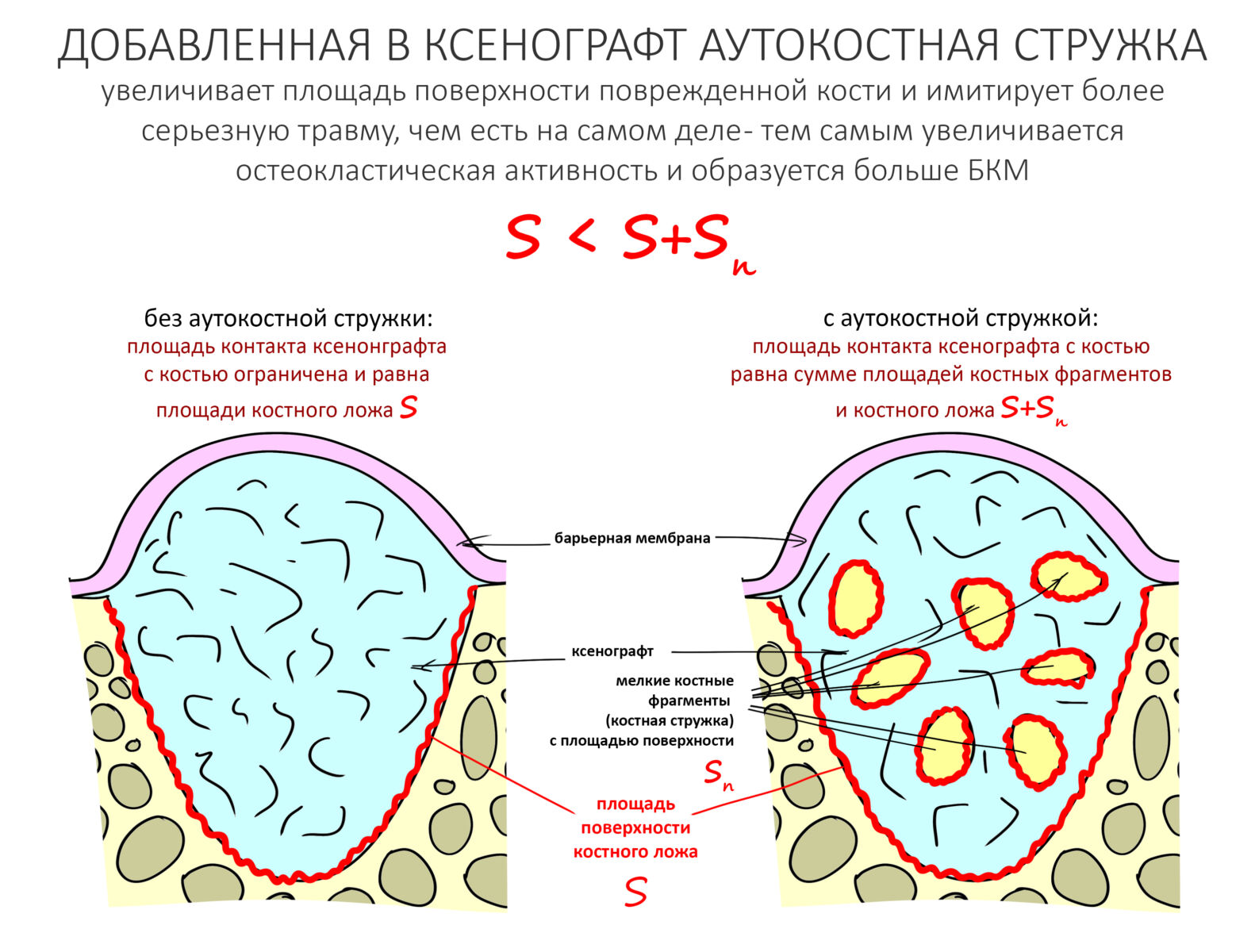
Для того, чтобы увеличить предел роста, мы вводим дополнительные фрагменты костной ткани, подлежащие разрушению и переработке макрофагами — аутокостную стружку. Таким образом, мы как бы увеличиваем макрофагальную активность путем увеличения площади контакта с поврежденной костью, т. е. имитируем травматические разрушения более серьезные, чем есть на самом деле.
В итоге, усиливается остеокластическая активность, мы получаем больше БКМ, увеличиваем предел роста, и это позволяет нам с помощью НКР восстановить даже большие костные дефекты.
И всё бы хорошо, если бы не несколько НО.
НО №1: аутокостная стружка является флогогеном, т. е. способствующим воспалению фактором. Чем больше будет аутокостной стружки, тем интенсивнее будет постоперационный воспалительный процесс, и в этих условиях легко потерять над ним контроль.
НО №2: разрушение аутокостной стружки макрофагами ведет к уменьшению объема графта, в результате чего результат наращивания костной ткани может быть значительно хуже, чем изначально планировалось. Многие авторы указывают на резорбцию 70% от изначального объема, мои личные наблюдения говорят о 50%. В случае использования жестких каркасов (сетки, костные пластины в методах Ф. Курри) это не проблема, а вот в классическом варианте НКР с использованием мягких резорбируемых мембран использование чистой аутокостной стружки ведет к катастрофе.
НО №3: для замещения большого по объему костного дефекта требуется эквивалентный объем аутокостной стружки, который нужно где-то взять. В этом случае получение достаточного количества аутографта из внутри- и внеротовых донорских зон существенно повышает травматичность операции НКР, что сводит на нет все её преимущества.
Поэтому в методике НКР используется остеокондукторный биоматериал, иначе называемый «спейсером». Его нерезорбируемые биоинертные гранулы позволяют удержать восполненный объем окружающий каркас (барьерную мембрану) на время, достаточное для регенерации костной ткани. Таким образом, выполняется одно из основных условий наращивания кости (удержание объема), и мы получаем хороший результат практически в запланированных границах:
О биоматериалах поговорим чуть позже, пока же рассмотрим то, что происходит в области операции после наложения швов.
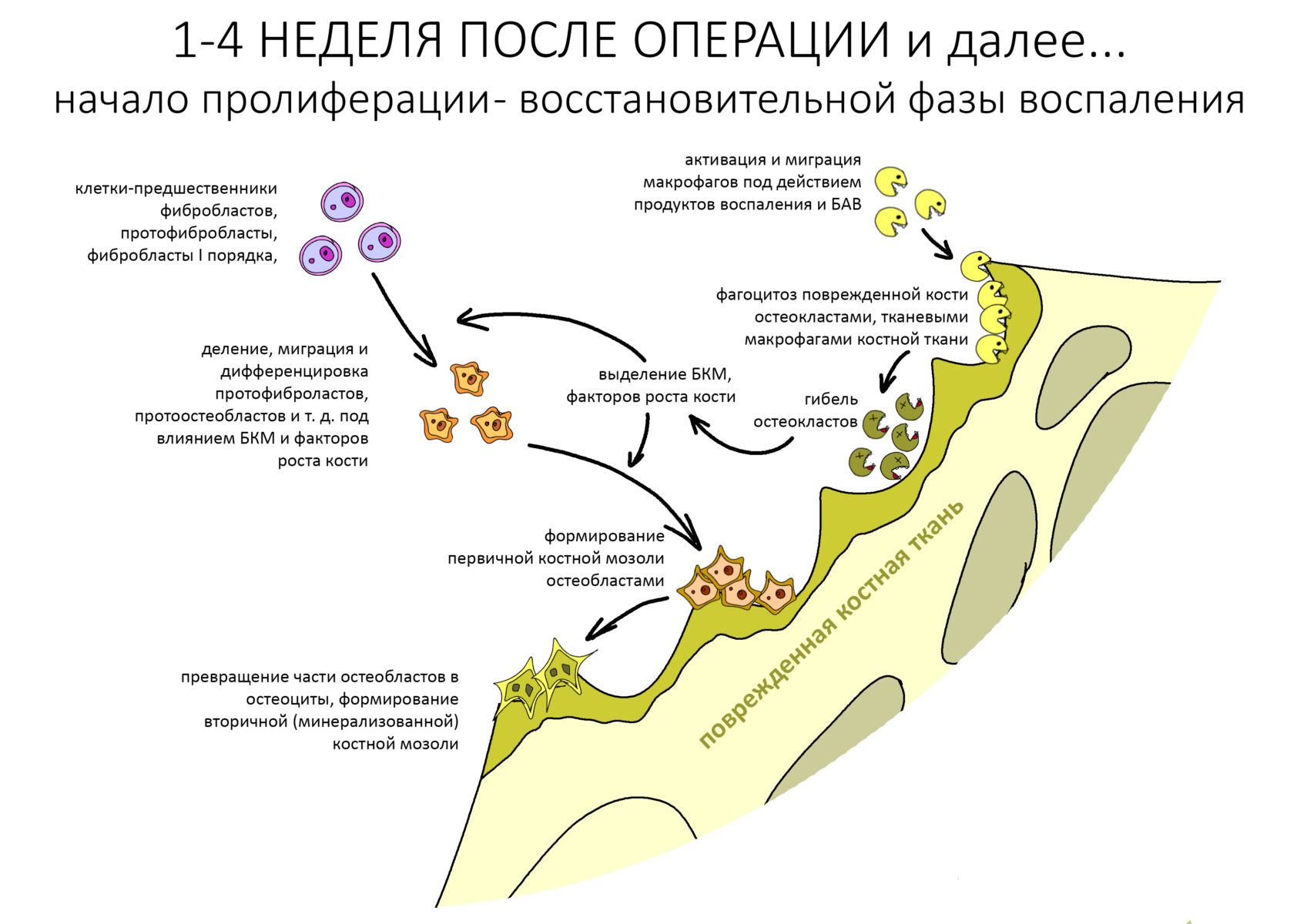
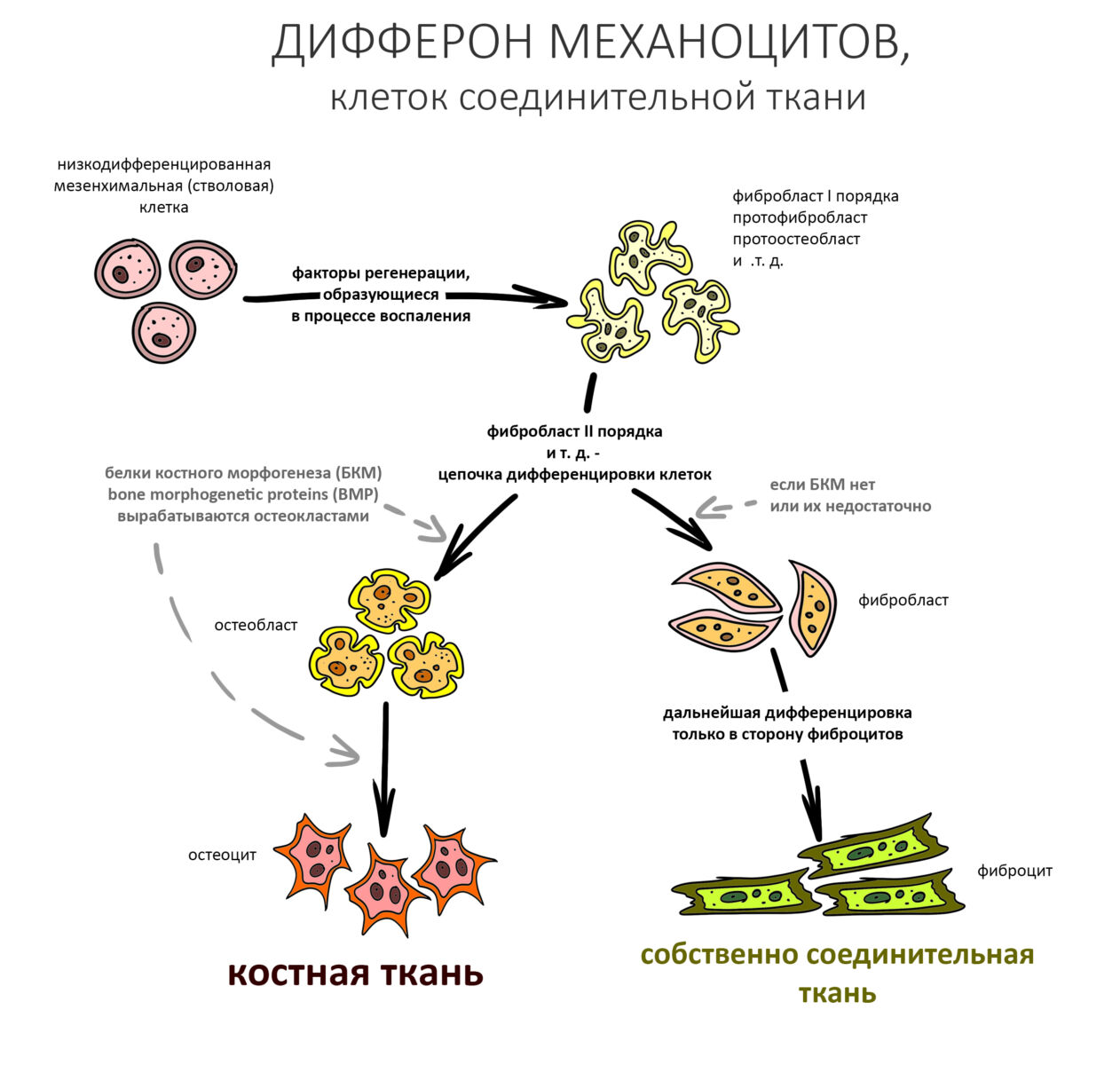
Первым делом развивается воспалительная реакция со всеми вытекающими: отеком, болезненными ощущениями, полнокровием и т. д. Запускается цитокиновый каскад, ряд продуктов которого активирует макрофаги, в т. ч. остеокласты. Те, в свою очередь, атакуют ранее обозначенную опсонами аутокостную стружку и стенки дефекта, после чего происходит их апоптоз и выделение БКМ. Белки костного морфогенеза, коих насчитывается несколько десятков видов, стимулируют миграцию и последующие превращения фибробластов и остеобластов согласно их дифферону.
При участии фибро- и остеобластов в пределах зафиксированного объема формируется т. н. «остеоид», первичная костная мозоль. Затем, по мере превращения части остеобластов в остеоциты, начинается его минерализация, т. е. образование вторичной костной мозоли. Этот процесс также идет от периметра к центру. Всё это время спейсер (остеокондуктор) практически не меняется и не участвует в процессе остеогенеза, зато отграничивающая восполняемый объем барьерная мембрана постепенно резорбируется, повышается её проницаемость, в процесс васкуляризации графта включается периост, до этого изолированный барьерной мембраной и изнасилованный хирургом в процессе ушивания раны.
В этом состоит суть метода направленной костной регенерации:
— с помощью остеокондуктора и барьерной мембраны создается и фиксируется каркас восполняемого объема костной ткани.
— с помощью аутокостной стружки стимулируется остеокластическая активность (имитация сильного повреждения), а она в свою очередь стимулирует миграцию и дифференцировку клеток костной ткани.
— нерезорбируемый остеокондуктор удерживает каркас на месте длительное время, достаточное для образования вторичной костной мозоли в области костного дефекта.
— готово!
Преимущества
Метод направленной костной регенерации имеет ряд преимуществ перед другими видами остеопластики.
Техническая простота
Мне сложно представить такую клиническую ситуацию, в которой было бы невозможно заполнить костный дефект графтом и перекрыть его барьерной мембраной. В отличие от других методов остеопластики, для которых существуют чисто технические ограничения (например, невозможность получить аутокостный блок нужного размера), НКР с помощью биоматериалов можно провести в 146% клинических случаев.
Ремарка: Эта самая техническая простота в совокупности с мнимой универсальностью сыграла с методом НКР злую шутку.
С одной стороны, популярность курсов, на которых пересказывают семинары Иштвана Урбана не просто велика - она огромна.
С другой, мы наблюдаем применение НКР везде, где только можно. И где не можно - тоже. В результате мы имеем гигантское количество осложнений.
Невысокая стоимость инструментов и оборудования
Если для проведения остеопластики методом остеотомии или аутотрансплантации нам требуется дорогостоящее оборудование, то в случае с НКР без него можно обойтись. Даже в самом нищебродском варианте все необходимые для НКР инструменты окупаются с первой же операцией, что делает методику очень популярной у новичков, студентов, универсалов и стоматологов на аренде, когда нецелесообразно вкладываться в покупку ультразвуковых хирургических систем и специальных наборов инструментов.
Низкая травматичность
В этом состоит главная «фишка» метода направленной костной регенерации — в ряде случаев за счет использования биоматериалов у нас отпадает необходимость в донорском участке, что позволяет значительно снизить травматичность хирургического вмешательства. Даже когда требуется аутографт (костная стружка), мы можем получить её прямо с области операции, либо сняв тонкий слой в любом удобном участке альвеолярного отростка — а это, согласитесь, никак не забор полноценного костного блока.
Возможность сочетания с имплантацией
При соблюдении ряда условий, можно сочетать НКР с установкой имплантатов. Причем, это сочетание дается проще, нежели при любом другом варианте остеопластики.
Подробно об этом можно почитать в соответствующей статье>>
Универсальность — ну почти.
Использование легко моделируемого порошкообразного графта позволяет без особых усилий восстанавливать костные дефекты даже очень сложной конфигурации. Поэтому НКР часто называют пафосным «3D-моделированием» кости. И действительно, остеотомия или аутотрансплантация блоков имеют ограничения по форме и количеству стенок костного дефекта, направленная костная регенерация таких ограничений не имеет.
Интуитивно понятная реализация
Ну, что может быть проще, чем «Замешал-наложил-закрыл-запинил-зашил»? Нет кости — насыпь графта вперемежку с аутокостной стружкой, перекрой барьерной мембраной — и будет тебе кость! Основная масса пересказчиков Урбана предлагают именно такую концепцию направленной костной регенерации, что с одной стороны, упрощает понимание процесса, но с другой — создает мнимое ощущение надежности и простоты. Это может сыграть с доктором и пациентом злую шутку. Очень злую.
Недостатки
Вместе с тем, метод НКР не лишен недостатков. Их всего три, но иногда они существенно ограничивают возможность реализовать его в конкретном клиническом случае.
Необходимость использования биоматериалов, барьерных мембран и графтов.
Как уже отмечалось выше, наиважнейшим условием НКР является фиксация и удержание восполняемого объема на время, необходимое для регенерации костной ткани. Поэтому НКР нельзя провести без использования биоматериалов, в частности графтов и барьерных мембран. Если при проведении остеотомии или аутотрансплантации мы часто можем обойтись без использования не только графтов, но и мембран, то в случае направленной костной регенерации сделать этого никак нельзя.
Кроме того, успешный результат НКР в значительной степени зависит от свойств используемых биоматериалов. Например, если ксенографт содержит органику (как правило, коллагеновые волокна), то стоит ожидать значительную резорбцию графта и, как следствие, неудовлетворительный результат остеопластики. То же самое можно сказать и про барьерные мембраны, чья низкая прочность и эластичность могут существенно осложнить проведение хирургического вмешательства.
Высокая себестоимость
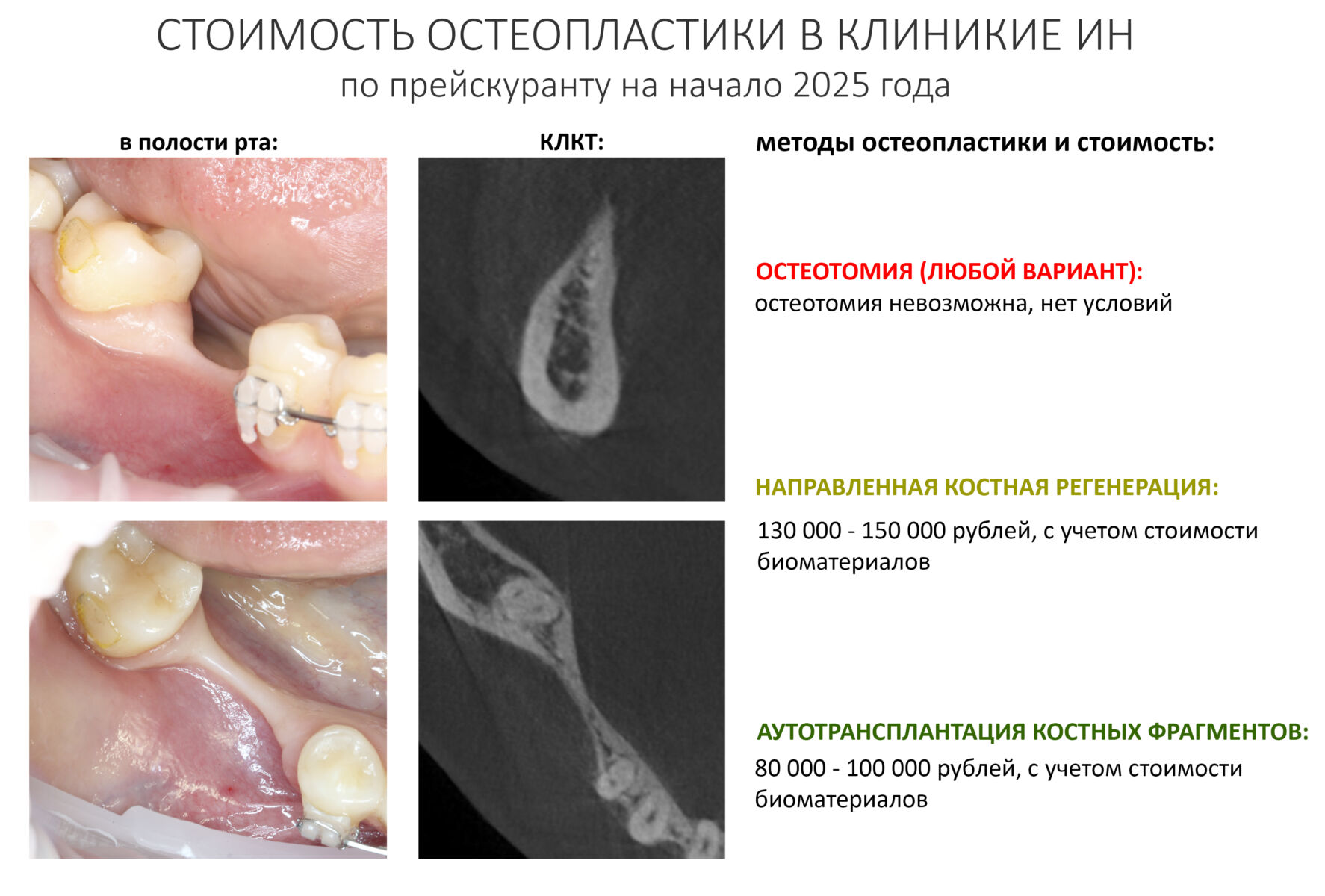
За подходящие для НКР биоматериалы нужно платить хорошие деньги, и это значительно увеличивает себестоимость хирургического вмешательства. В некоторых случаях на их долю приходится половина и более от цены операции остеопластики. Так, если мы возьмем костный дефект такой конфигурации:
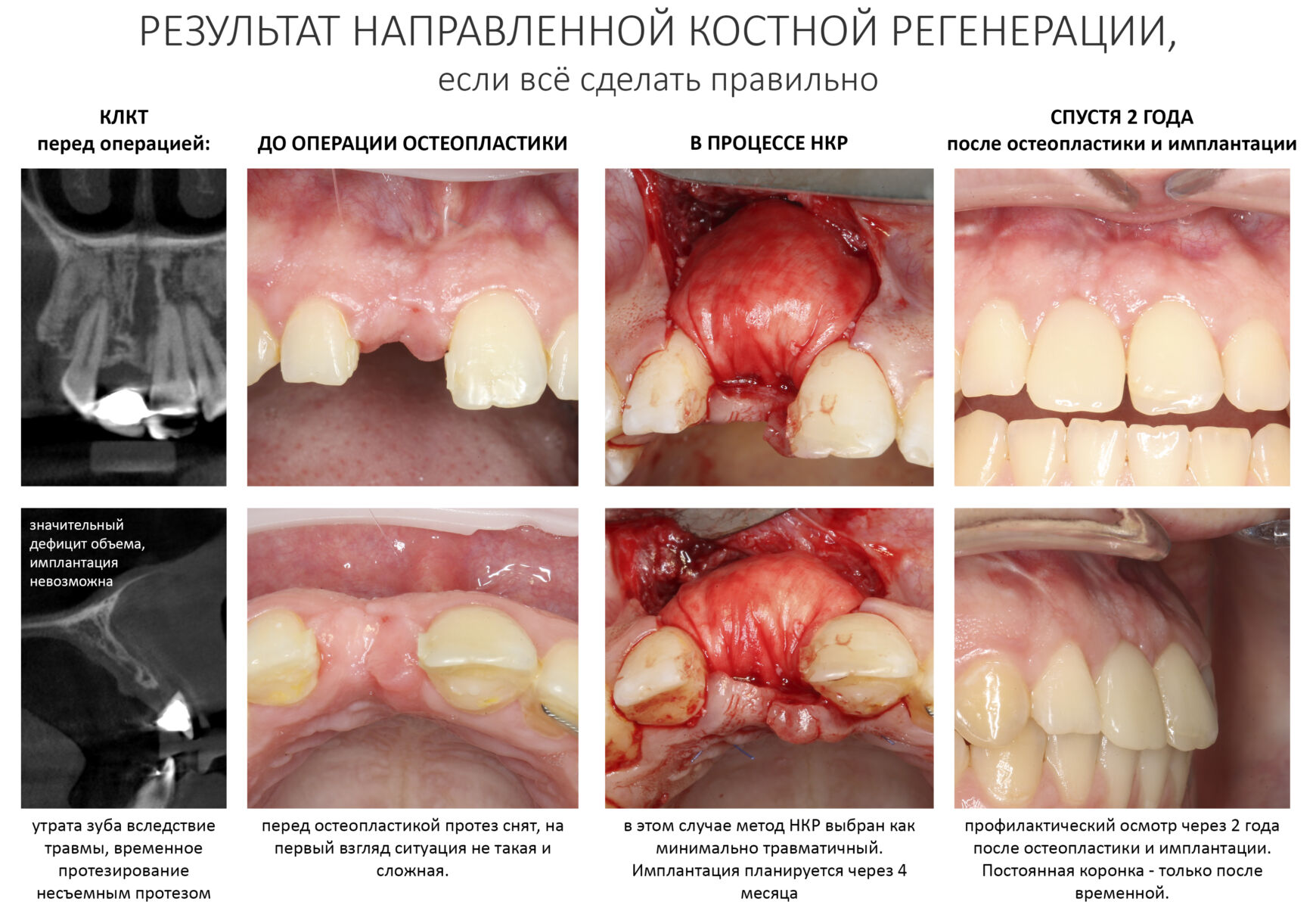
то по текущему (начало 2025 года) прейскуранту Уютной КЛИНИКИ ИН его восстановление методом аутотрансплантации обойдется в 80-100 тысяч рублей, в то время как НКР, будучи совершенно равнозначной по результату, будет стоить в полтора-два раза дороже, именно за счет стоимости используемых биоматериалов.
Значительная зависимость от местных факторов, кровоснабжения и структуры костного ложа.
Строго говоря, эффективность любого метода остеопластики зависит от местных факторов, но в случае с НКР эта зависимость особенно заметна. Тут в очередной раз необходимо осознать, что сама по себе операция не наращивает костную ткань, а создает условия для её регенерации в нужном нам направлении. Потому даже если НКР выполнена идеально и по всем правилам, то это никак не гарантирует, что мы получим желаемый результат. Хотя бы потому, что интенсивность миграции фибро- и остеобластов в графт будут зависеть от их количества на костной поверхности, а оно в свою очередь — от биотипа костной ткани и площади поверхности.
Конечно же, нельзя не учитывать состояние микроциркуляторного русла, локальную гемоперфузию, на которые будет влиять, в т. ч. и общее состояние организма, возраст, хронические заболевания, вредные привычки и т. д. Ежу понятно, что серьезная сердечно-сосудистая патология неизбежно сказывается на васкуляризации графта, что может быть критичным для результативности любого вида остеопластики, но для НКР — особенно.
Выбор метода
В контексте выбора, мы рассмотрим не возможность проведения (или отказа) от остеопластики, как таковой, а критерии, при которых метод НКР является наиболее предпочтительным. Причем для доктора, в равной степени владеющим любой методикой наращивания костной ткани и имеющим для этого все технические и инструментальные возможности.
Ремарка: нередко предпочтение НКР отдается лишь из-за того,
что у доктора или клиники нет возможности проведения остеопластики каким-либо другим методом.
Нередко в процесс выбора вмешиваются чисто профессиональные амбиции и банальная человеческая жадность.
Бывает, что НКР предлагается в качестве "безальтернативного" метода.
Разумеется, это неправильно и влечет вполне предсказуемый результат.
Существует несколько критериев выбора:
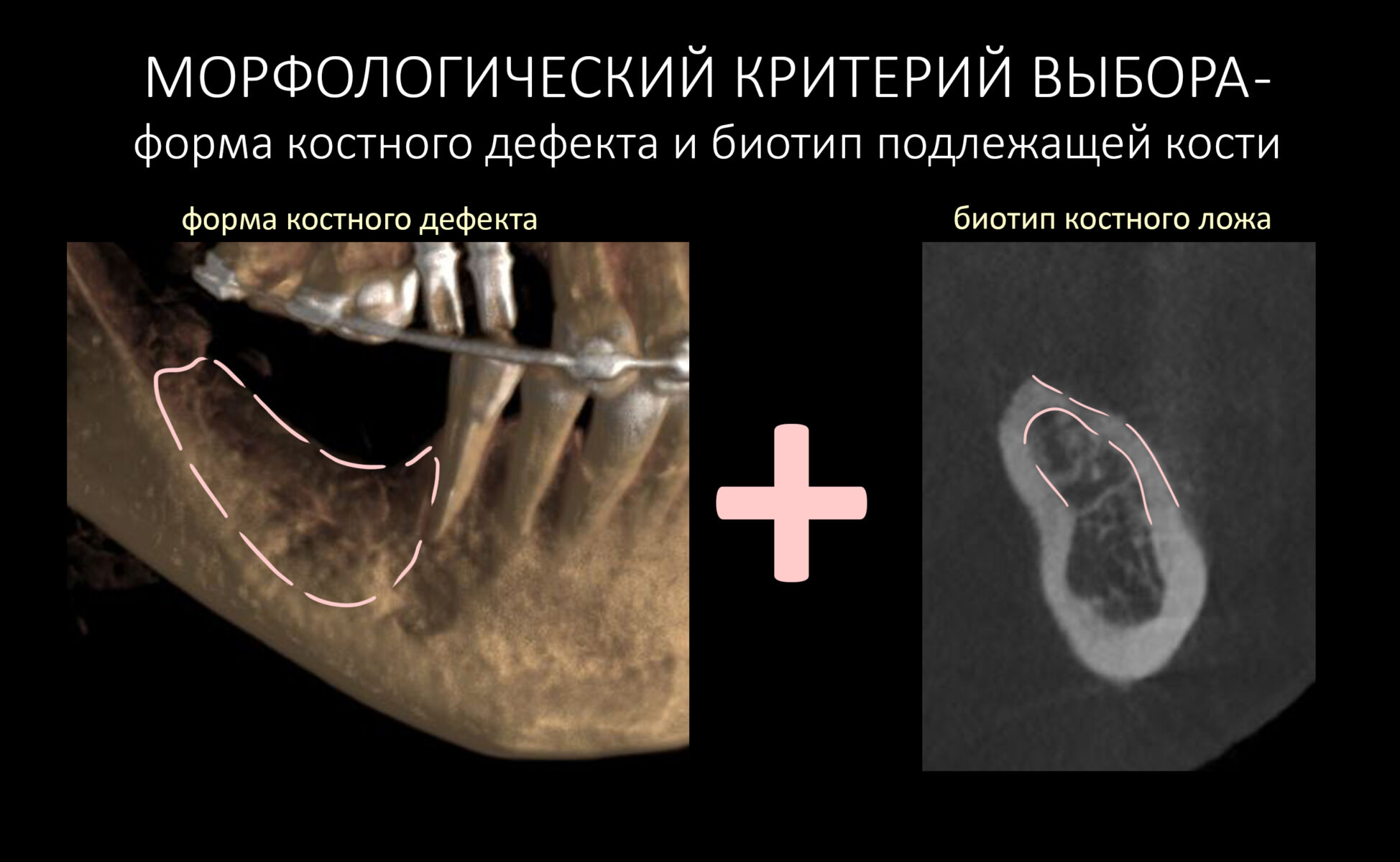
1. Морфологический
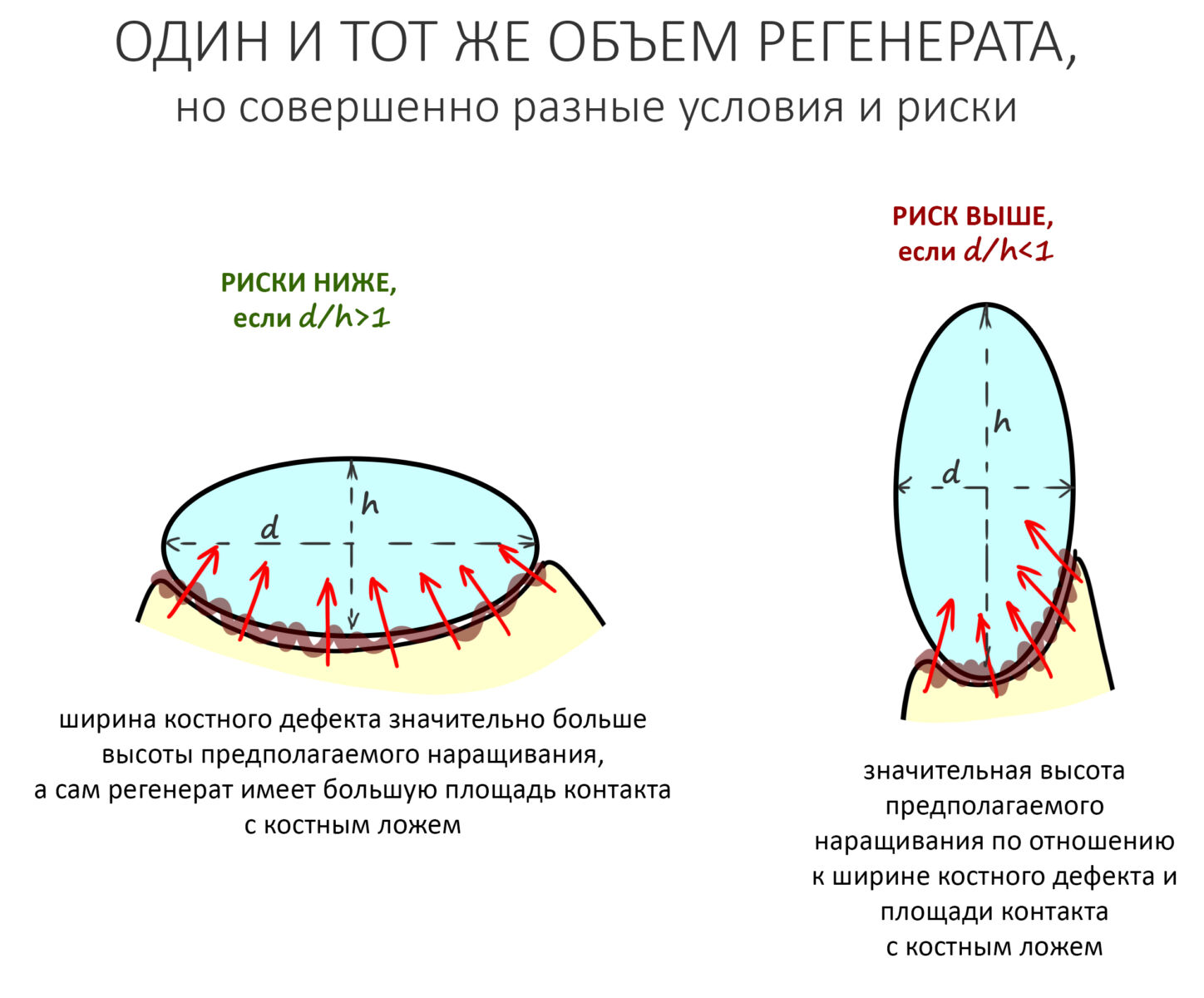
Форма и локализация костного дефекта, биотип костной ткани. Я уже писал об этом в статье, посвященной выбору метода остеопластики. В случае с направленной костной регенерацией это имеет решающее значение. Я с полной ответственностью могу заявить, что 99% неудач НКР связаны именно с неверным отбором пациентов. Почему? Потому что успех операции целиком зависит от интенсивности васкуляризации, заселения клетками графта и уже упоминавшегося предела роста. А они, в свою очередь — от морфологии костной ткани в зоне дефекта. Поэтому рискованными являются клинические ситуации:
— если площадь контакта восстанавливаемого костного дефекта с периостом значительно превышает площадь его контакта с костной тканью. Проще говоря, высота наращиваемого объема значительно превышает его ширину:
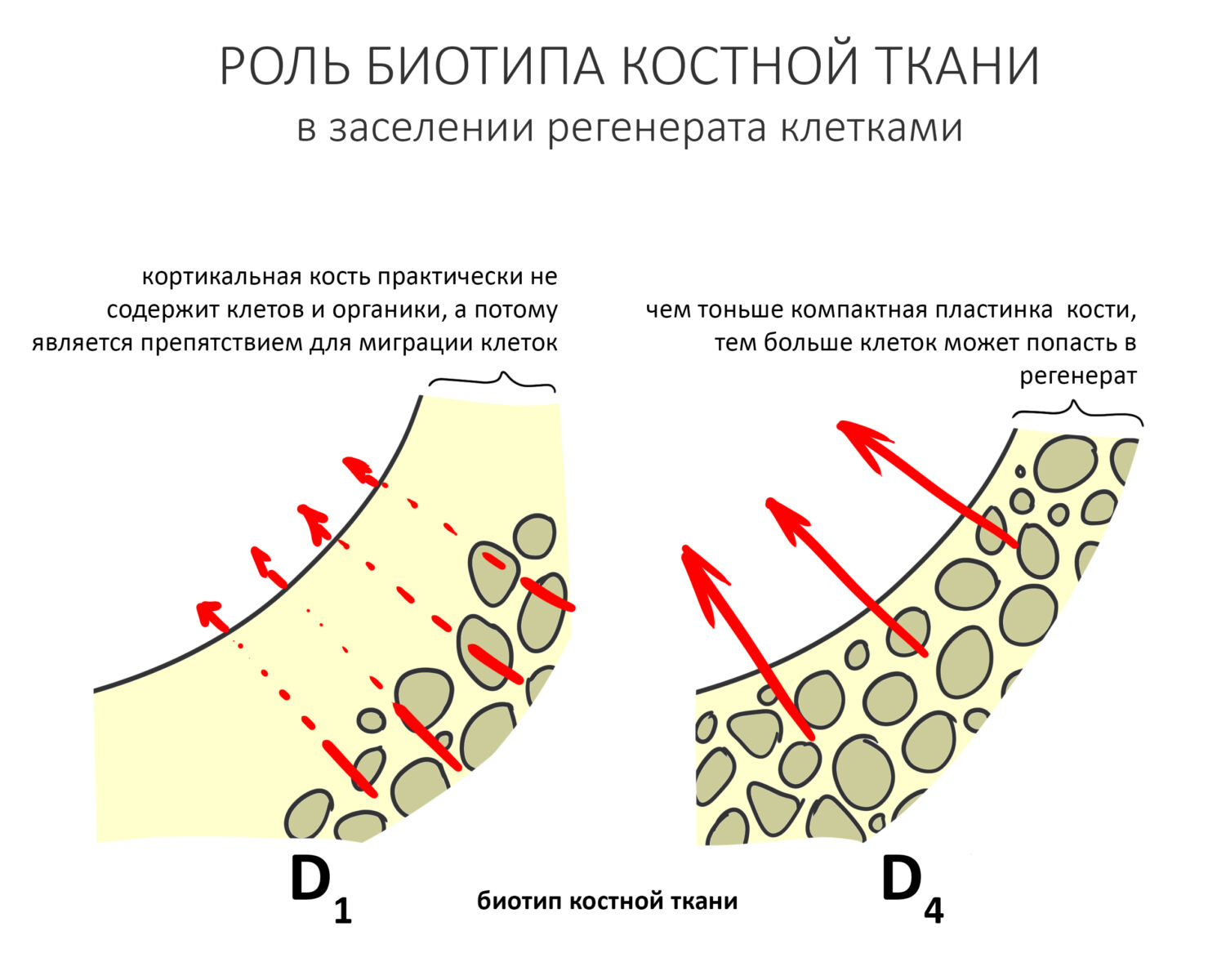
— кортикальная костная ткань содержит минимум органики и практически лишена способных к миграции клеток, остеобластов. Чем толще подлежащая кортикальная пластинка, тем меньше клеток будут попадать в графт, тем хуже прогнозы по НКР. В случае с биотипами D1-D2 лучше рассмотреть другие способы остеопластики, метод направленной костной регенерации стоит выбирать в самую последнюю очередь.
Итого, мы получаем два параметра, форма дефекта и биотип подлежащей кости, объединенные в морфологический критерий выбора.
Кстати, именно его чаще всего игнорируют доктора и в результате получают значительное количество осложнений после НКР.
2. Технологический
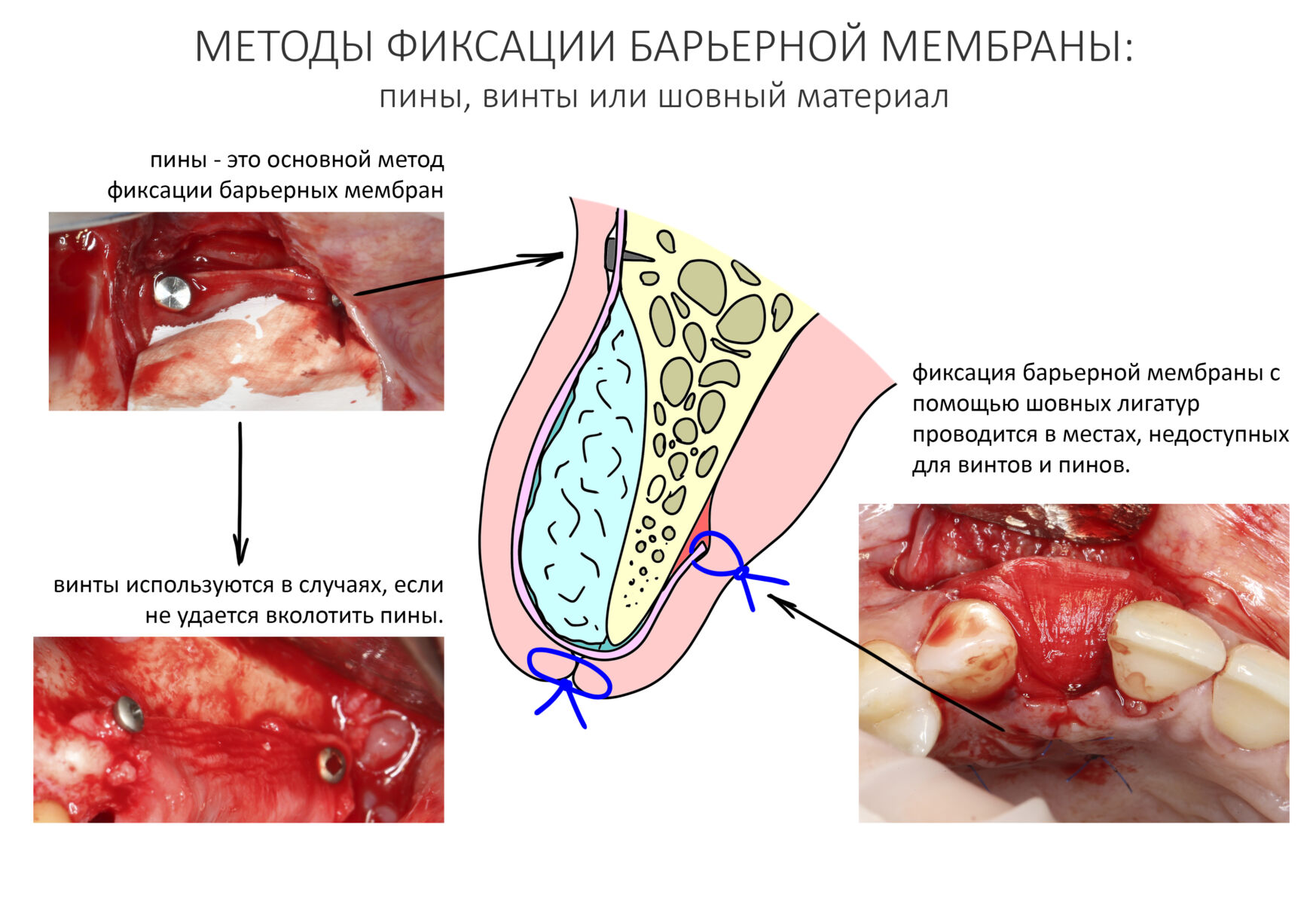
Я уже отмечал, что для эффективной реализации метода НКР нужно хорошо зафиксировать и натянуть барьерную мембрану. Для этого используются пины, что-то вроде маленьких гвоздиков или канцелярских кнопок, винты или шовный материал:
Соответственно, у доктора должна быть возможность провести фиксацию и задать нужное натяжение барьерной мембраны. Как хирургу, который провел несколько сотен остеопластических операций методом НКР, мне сложно представить ситуацию, когда такая возможность отсутствует. Чаще проблемы возникают с выбором вариантов фиксации, например, доктор вместе более простых швов пытается использовать пины и т. д. Потому технологическую возможность натяжения и фиксации мембраны можно отнести к критериям выбора метода.
3. Финансовый
Мы снижаем травматичность НКР за счет использования биоматериалов. Если в других методах остеопластики без графта и барьерной мембраны иногда можно обойтись, то в НКР без них никак. Более того, для НКР имеют значение свойства биоматериалов и, если они отличаются от заявленных, появляются лишние риски для результата. Такие «проверенные» графты и мембраны стоят немалых денег. С одной стороны, это хорошо — некоторые врачи, не стесняясь, занимаются продажей биоматериалов пациентам. С другой, даже очень небольшая по объему хирургическая операция получается очень уж дорогой, от того не по карману некоторым людям. В моей практике было не один и не два случая, когда мы отказывались от НКР в пользую иной методики остеопластики как раз по причине её высокой стоимости.
Если бы стоматология была бесплатной, то финансовый критерий выбора нас бы не беспокоил. Но пациенты платят , поэтому я считаю очень важным не просто учитывать финансовую составляющую лечения, но и распоряжаться ей максимально разумно и во благо. Если пациент, которому требуется остеопластика, не тянет её по финансовым причинам, то это не значит, что ему нужно залезать в долги и кредиты — в большинстве случаев можно выбрать другой, более доступный метод наращивания костной ткани.
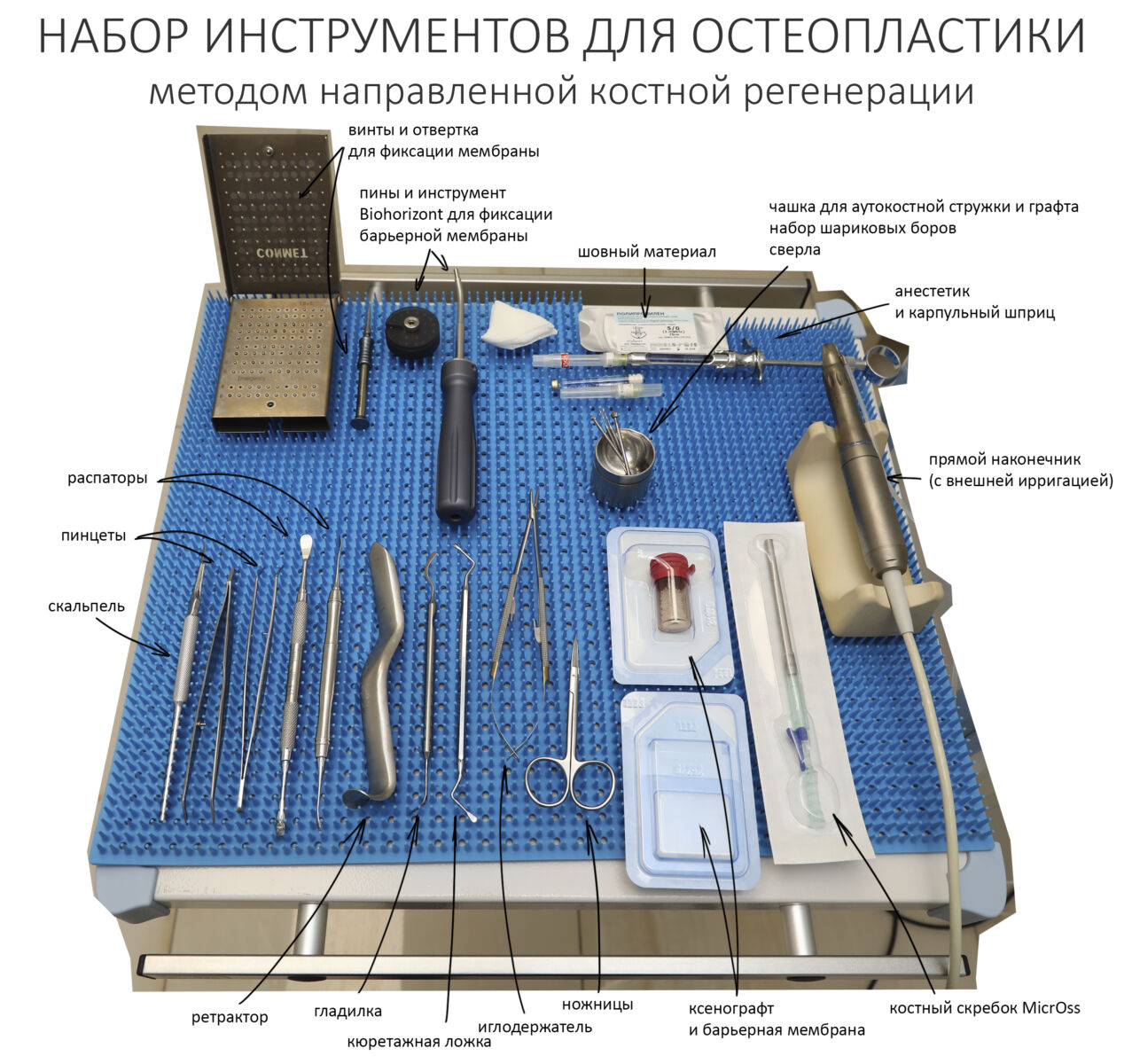
Материалы и оборудование
Как уже отмечалось ранее, проведение НКР не требует какого-то особого оборудования или специального инструмента. Наш хирургический набор на эту операцию выглядит следующим образом:
Я призываю не заморачиваться на пинах для фиксации барьерной мембраны. Их множество: ударные, безударные, разной формы и разных производителей. Выбор из этого множества — исключительно вопрос навыка и удобства. Наконец, в ряде случаев можно вообще обойтись без пинов и использовать для фиксации барьерной мембраны обычные титановые винты.
Но вот на что я действительно рекомендую обратить внимание, так это на инструмент для получения аутокостной стружки.
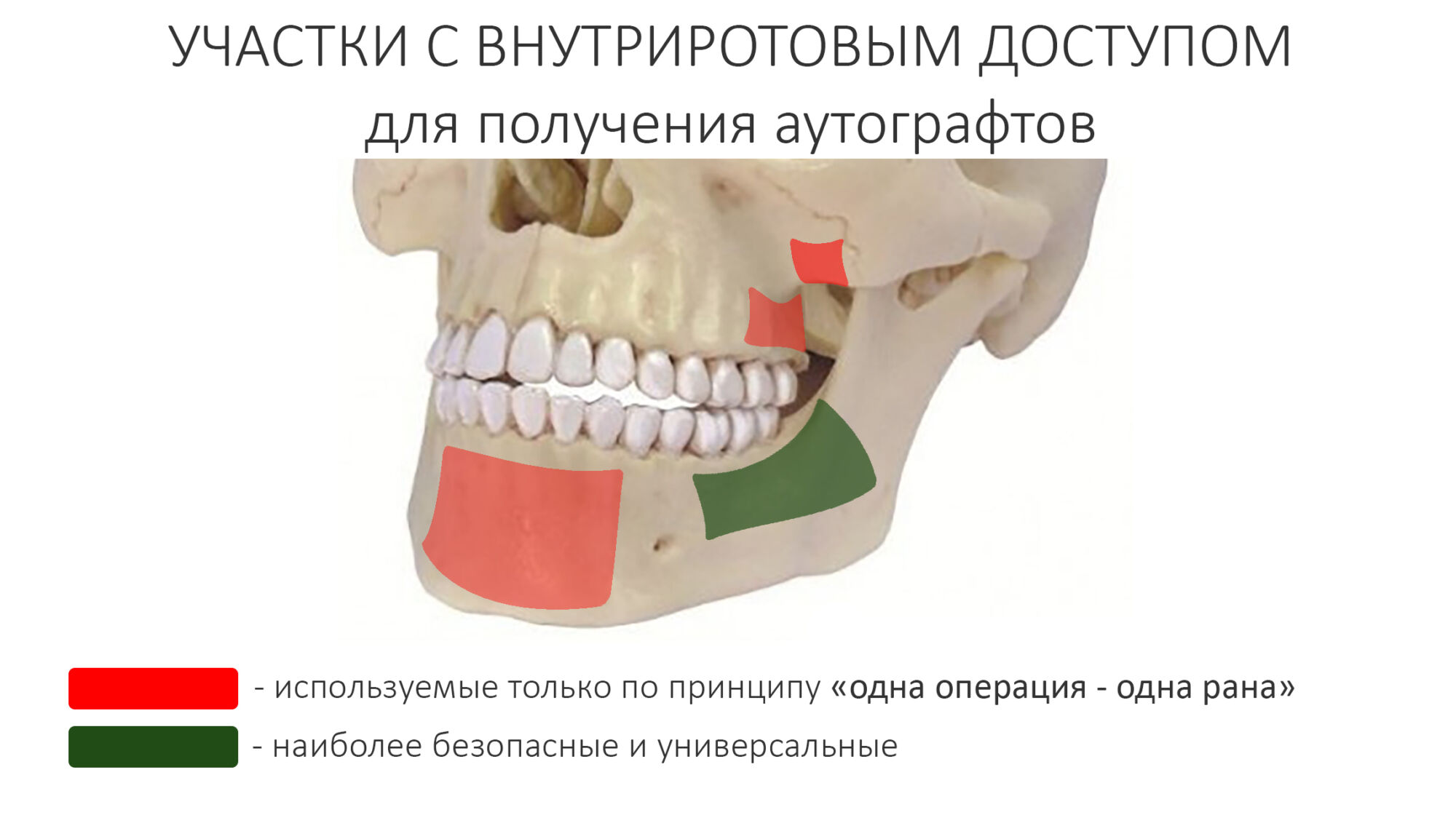
Тут нужно учесть, что в амбулаторных условиях, коими является чуть менее, чем любая стоматологическая клиника, забор аутографта осуществляется исключительно из внутриротовых источников. Истории с забором кости из подвздошного гребня, надколенника, большеберцовой или теменной кости — не наша тема. Да и не стоят они того, если вспомнить современные наработки имплантологии/протезирования в условиях сильной атрофии челюстей.
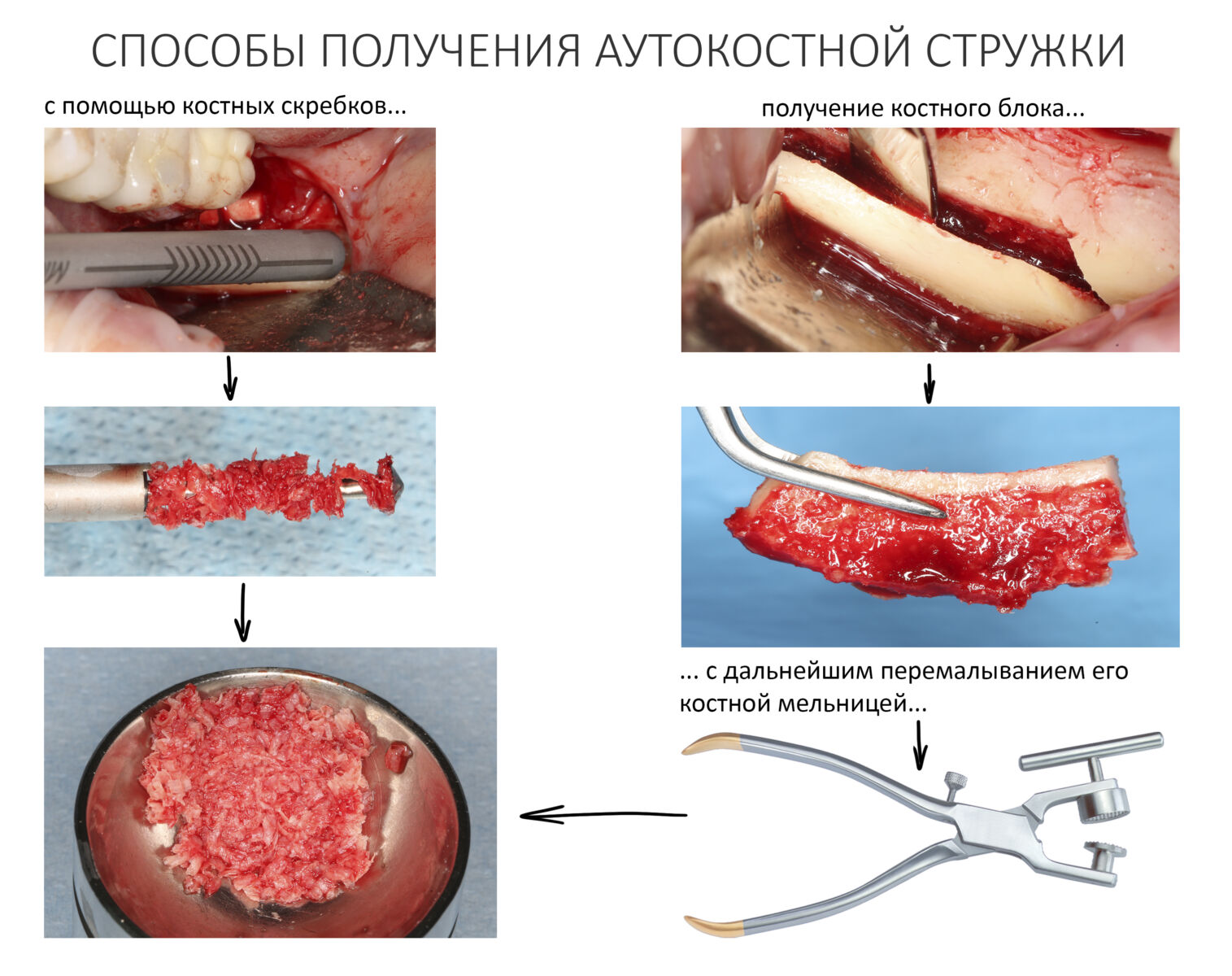
Есть два способа получения аутографта для НКР из внутриротовых источников:
Первый способ подразумевает получение из донорской зоны костного блока с последующей его переработкой в стружку с помощью т. н. «костной мельницы». Этот способ сводит на нет все преимущества НКР как метода: во-первых, травматичность подобного подхода такая же, как при аутотрансплантации, во-вторых, КПД костных мельниц оставляет желать лучшего (много потерь), из-за чего выделяемый костный блок должен быть большего объема, чем требуемый объем аутокостной стружки. В общем, способ не сильно эффективный (особенно при малых объемах), довольно геморройный, а потому подходит, разве что, для комбинированных методик остеопластики при восстановлении больших по размеру костных дефектов.
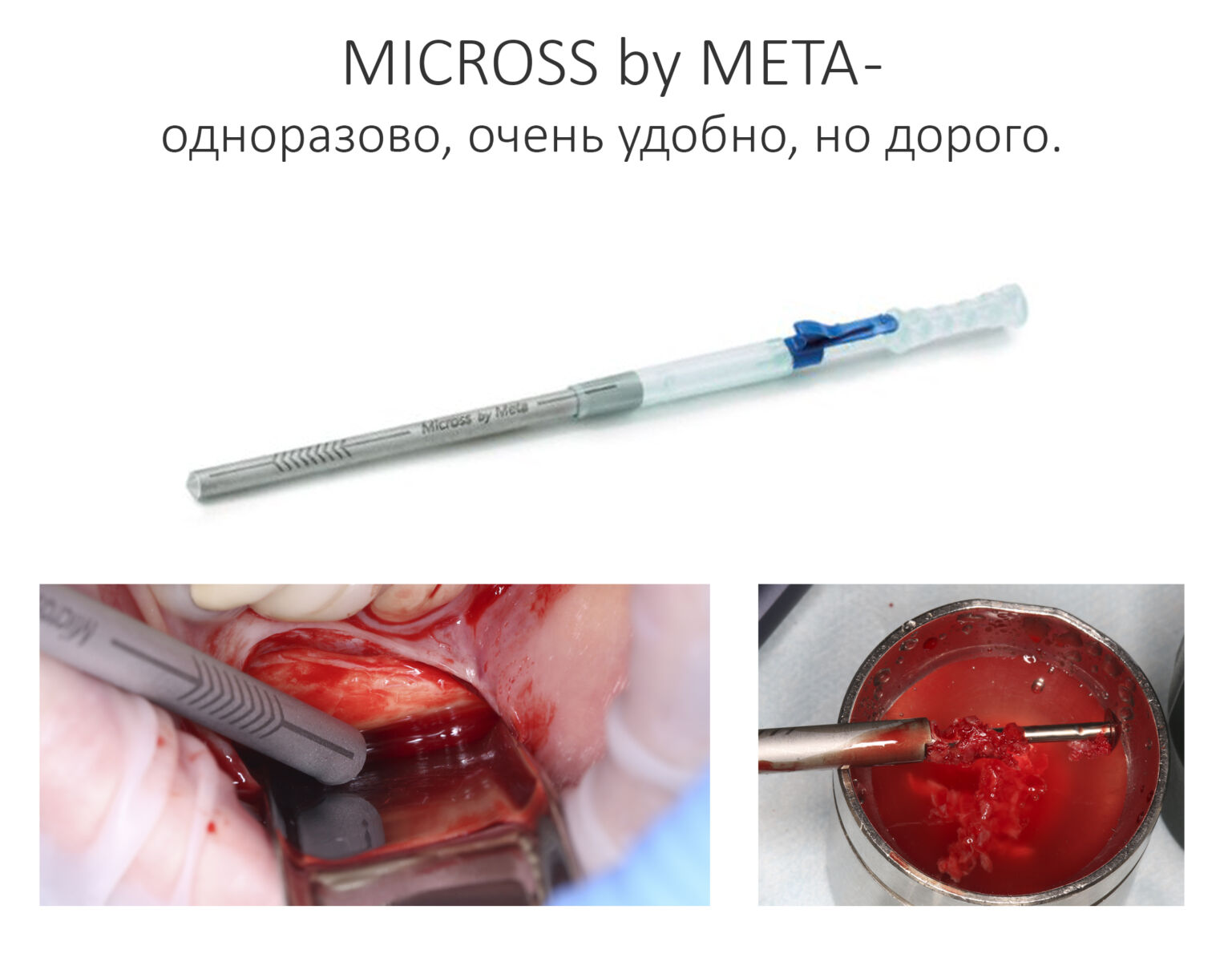
Во втором способе используются костные скребки (харвестеры и костные ловушки) различных конструкций, ручные и с приводом, одноразовые и многоразовые.
За те 16 лет, что я занимаюсь остеопластикой, мне удалось испытать разные остеохарвестеры разных конструкций, потому сейчас я используют исключительно MicrOss итальянской компании META, известной вам тем, что разработала аппликатор для Bio-Oss Pen. Да, дорого. Да, требует определенного навыка. Зато компактный размер не требует большой раны в донорском участке, а получаемая аутокостная стружка имеет идеальную консистенцию для последующего применения.
Впрочем, выбор костного скребка — это вопрос привычки, я вполне допускаю, что существуют другие, более удобные способы забора аутокости. Например, уважаемый мной профессор Сергей Едранов предложил использовать для получения аутокостной стружки с помощью имплантологических фрез большого диаметра. Для этого настраивают физиодиспенсер на режим 50-100 об/мин, момент силы 30-50 Нсм с минимальным орошением или отсутствием ирригации — и вуаля! Можно получить небольшой объем аутографта для небольшого по размеру костного дефекта.
В остальном, мы используем совершенно обычный хирургический стоматологический инструмент.
Что же касается материалов, то основными и обязательными являются графты и барьерные мембраны. Во избежание возможных инсинуаций, я отмечу раз и навсегда, что
какой-то принципиальной разницы между биоматериалами разных производителей нет и быть не может
То есть, мы можем получить удовлетворительный результат НКР, используя совершенно любой графт и любую барьерную мембрану. Истории про то, что «этот костный порошок лучше и эффективнее вот этого» придумали рукожопы, пытаясь переложить ответственность за свои косяки на производителя.
О графтах и мембранах написано много, стоит почитать тут>> и, например, здесь>>. Почитайте, это интересно.
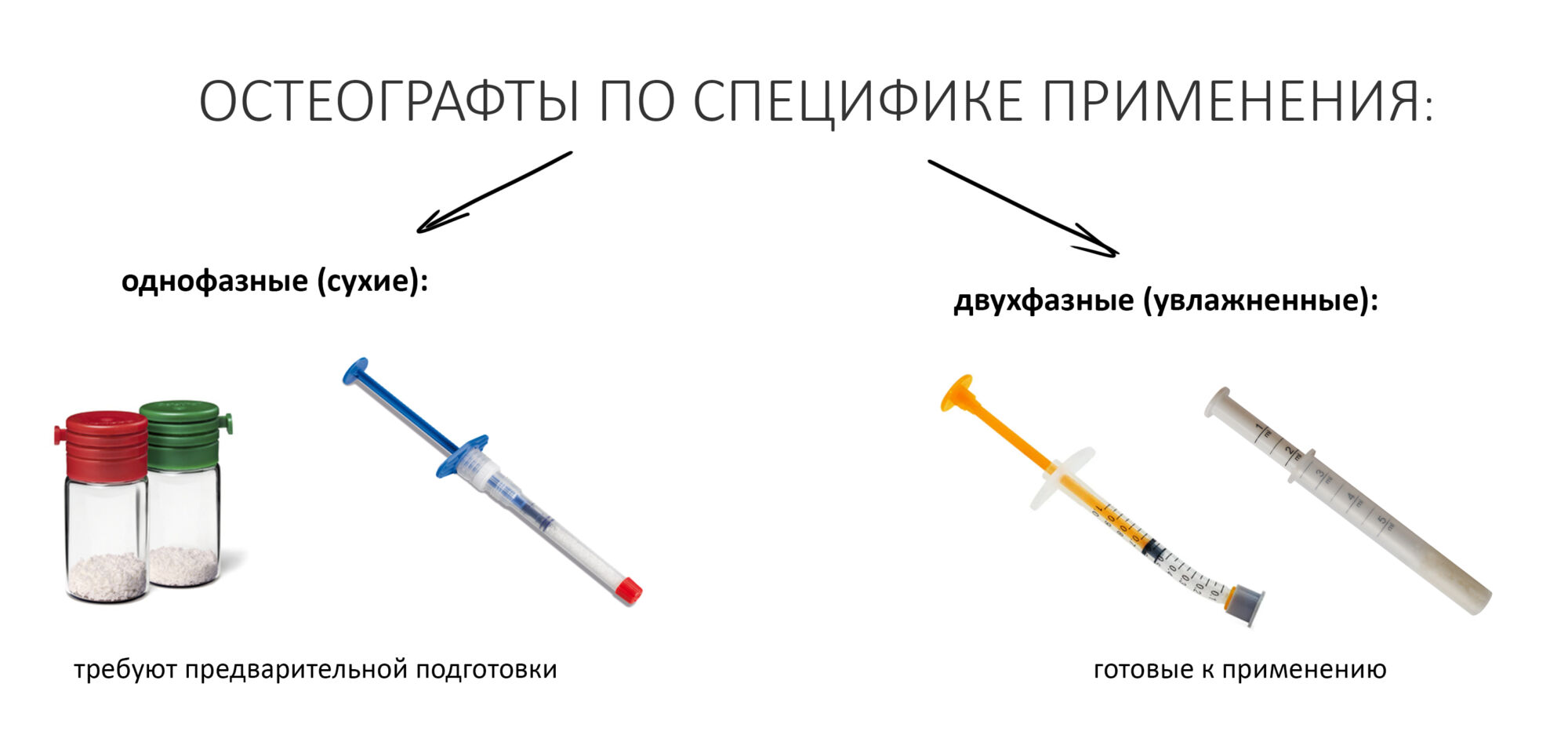
Графты
Основной используемый форм-фактор графтов при НКР — это рассыпные крупинки, гранулы, чипсы и т. д. Оно и понятно — мы должны смешать его с аутокостной стружкой для получения микса. В таком виде выпускается огромное количество различных графтов, можно выбрать тот, который удобнее и понятнее.
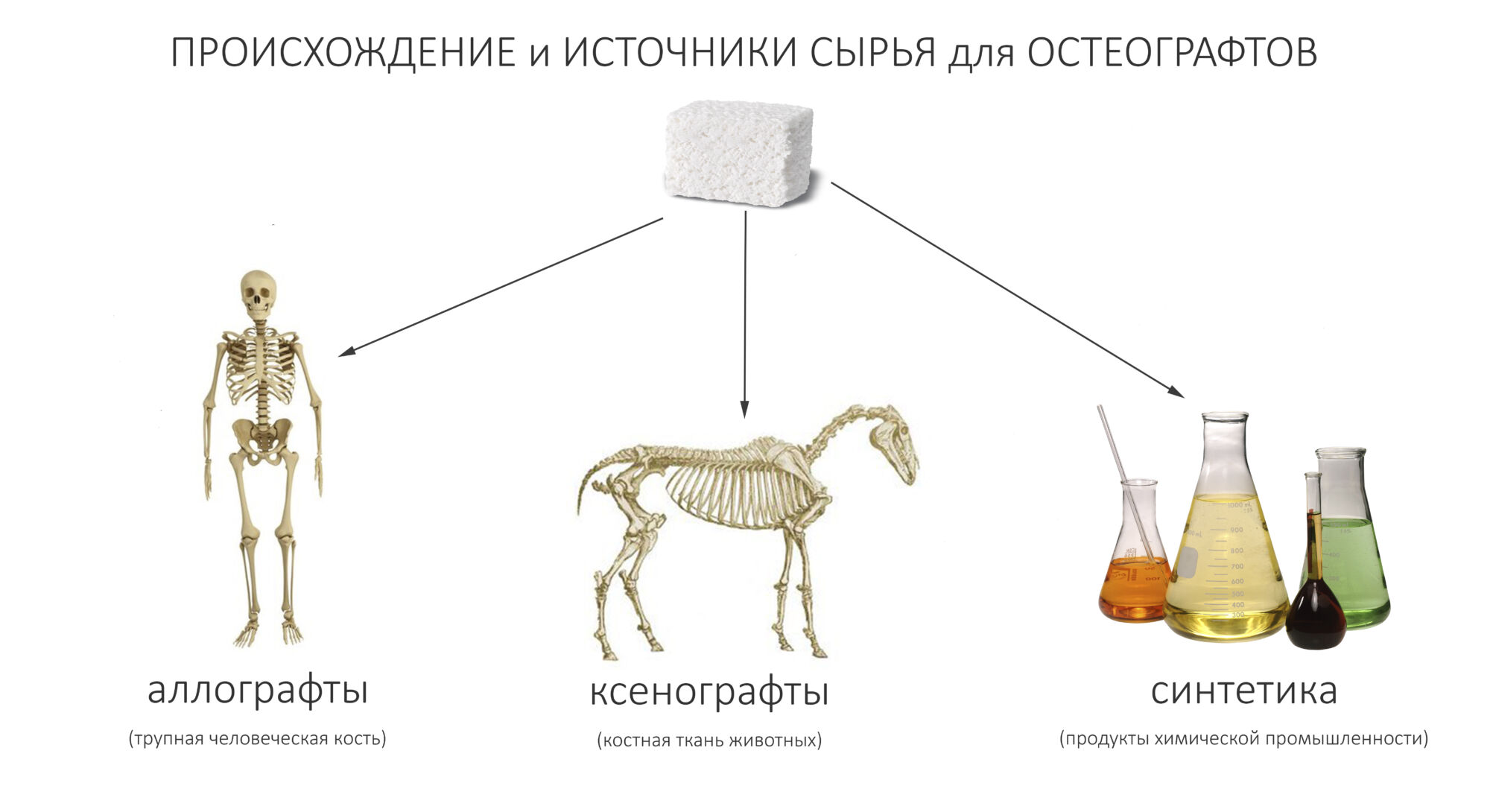
Используемые в стоматологии графты можно разделить по происхождению:
наличию органики (исключительно ксенографты):
специфике подготовки и применения:
Еще раз подчеркну, — И ЭТО ВАЖНО! — что какой-то принципиальной разницы в принципах действия (а значит, в эффективности) между разными типами графтов нет. Нет никаких данных о том, что аллографты более эффективны в сравнении с ксенографтами. При этом, аллографты намного более требовательны к отбору сырья и технологии производства, следовательно никак не могут быть дешевле и доступнее, чем ксенографты животного происхождения. Почему на практике происходит иначе — этот вопрос стоит задать производителям аллографтов.
Что же касается органики, в частности коллагена… вы знаете, что происходит с коллагеном гемостатической губки, барьерной мембраны и т. д. Наивно полагать, коллаген в графте ведет себя как-то по-другому. Проще говоря, он, как и любая «левая» органика резорбируется, графт теряет в объеме, а это может оказаться критичным для успеха остеопластики.
Идеальный вариант — это 100% минеральный однофазный ксенографт в гранулах. Такой, как Bio-Oss, который известен с 1985 года и который я использую в своей практике вот уже 16 лет. За это время мы перепробовали многое, но всё время возвращались к нему. Возможно, это дело привычки, но я считаю, что делать сложные операции за 100 и более тысяч рублей и при этом экономить на материалах — стыд и позор.
Барьерные мембраны
С барьерными мембранами всё сложнее, поскольку от её свойств будет зависеть сама возможность правильного проведения хирургической операции. Например, если барьерная мембрана не обладает достаточной прочностью и прорезается фиксирующими пинами, то операция остеопластики может превратиться в пытку для доктора и пациента с неясным результатом. Неэластичная барьерная мембрана потребует больше пинов для фиксации. И так далее.
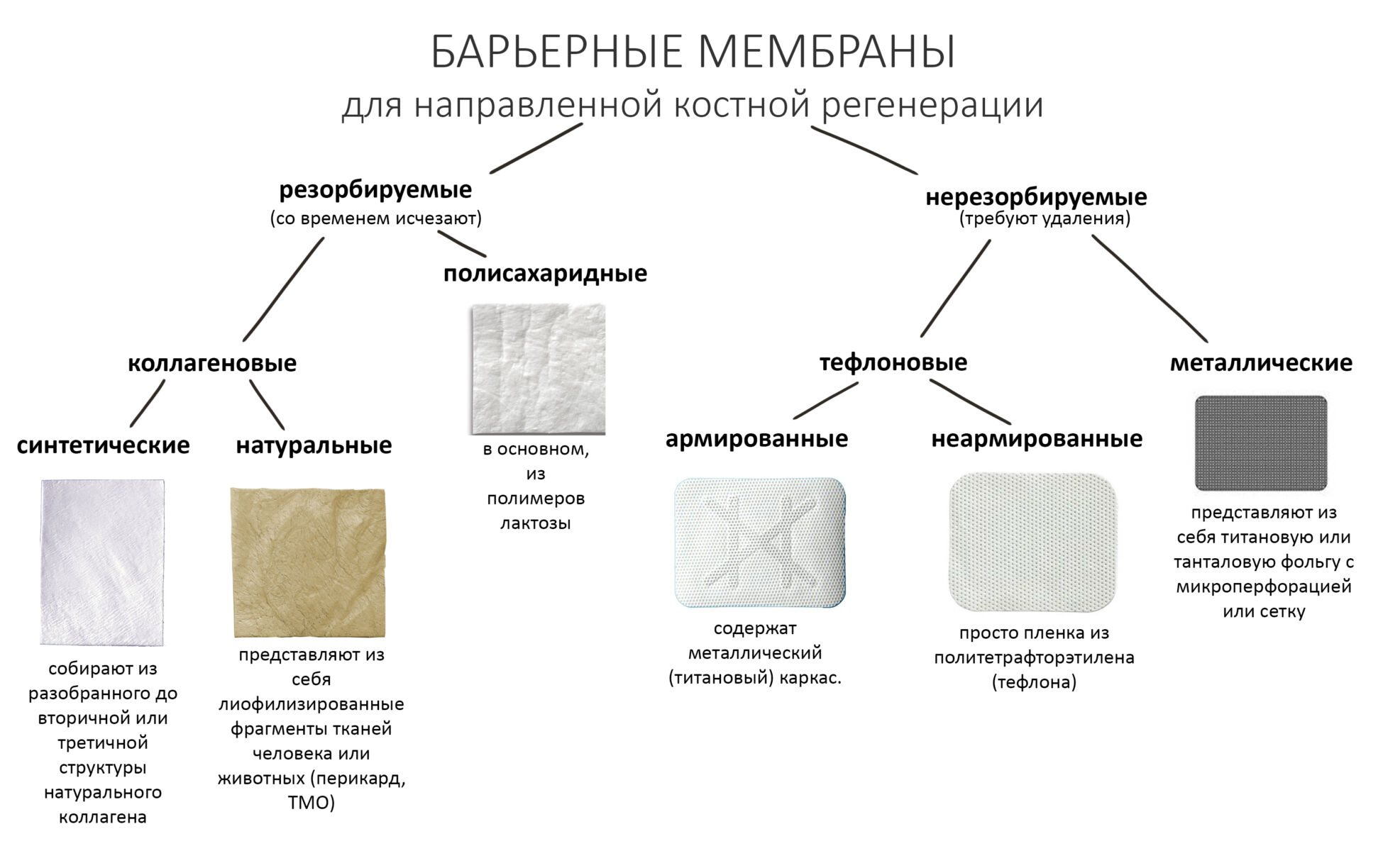
Для НКР используются резорбируемые и нерезорбируемые барьерные мембраны. Последние изготавливают, как правило, из тетрафторэтилена, более известного как тефлон (PTFE). Для удобства моделирования и придания жесткости такие мембраны иногда имеют встроенный титановый каркас.
С резорбируемыми мембранами всё еще сложнее. Глобально и по происхождению их можно разделить на две группы, полисахаридные и коллагеновые.
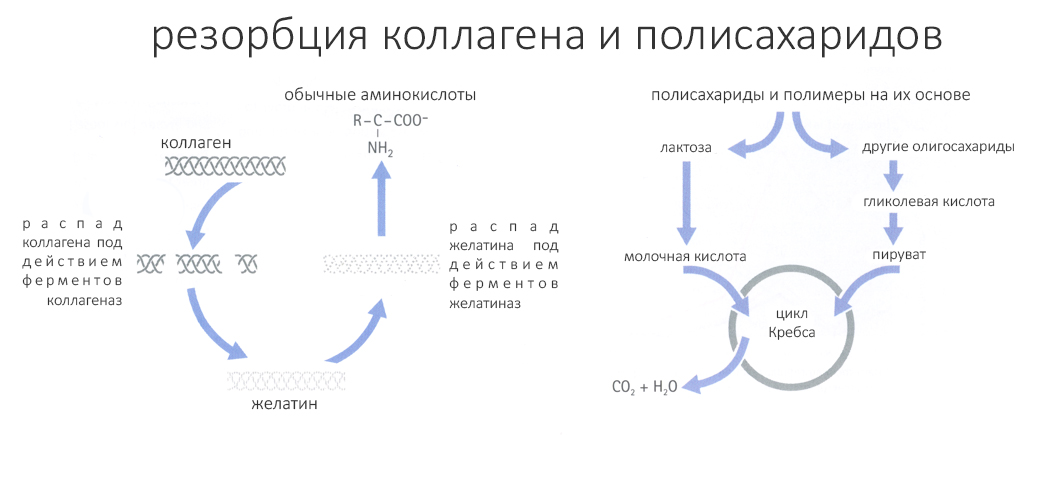
Кэп Очевидность подсказывает, что коллагеновые мембраны изготавливают из коллагена. В качестве сырья используется тропоколлаген животного происхождения (в основном, свинья), который наносится на подложку электростатическим методом или осаждением из раствора. Сырьем для неколлагеновых резорбируемых мембран являются полисахаридные полимеры — те же самые, что используются для производства резорбируемого шовного материала (Викрил). В этом есть важный нюанс, поскольку резорбция коллагеновых и неколлагеновых мембран идет разными биохимическими путями:
Этим объясняется разница в сроках резорбции — полисахаридные мембраны деградируют дольше. Но, что намного важнее, продукты их деградации прямым образом влияют на то, что происходит в ране после наложения швов. Вызванный воспалением местный ацидоз (который, кстати, является одной из причин болевого синдрома) усугубляется продуктами распада полисахаридов барьерной мембраны, кислотами. Буферные системы тканей в области операции на грани, а мы тут еще добавляем кислоты… ежу понятно, что это сказывается на заживлении не самым лучшим образом.
С другой стороны, полисахаридные мембраны дешевле, могут применяться у пациентов, ограниченных этическо-религиозными нормами, потому я не могу сказать что они совсем уж плохи. Просто использовать их нужно с осторожностью.
Как и в случае с графтом, за 16 лет, что я занимаюсь остеопластикой, мне довелось использовать в работе множество разных барьерных мембран. Более того, когда я читал RegenerationDay и активно сотрудничал с множеством компаний, я предметно изучал барьерные мембраны, провел серию экспериментов для оценки их свойств. Потому полной ответственностью могу заявлять, что при должных навыках и правильном использовании, можно получить хорошие результаты с любой из имеющихся на рынке барьерных мембран. В своей практике мы используем Bio-Gide. Просто потому, что ее свойства нас устраивают.
Особенности создания миксов из ксено- и аутографта.
Как уже отмечалось ранее, использовать чистую аутокостную стружку для НКР нельзя, поскольку из-за её значительной резорбции можно потерять результат. При восстановлении больших по объему и сложных по конфигурации костных дефектов альвеолярного отростка биотипов D1-D2 нельзя использовать чистый графт, поскольку здесь нас ограничивает предел роста. При этом нет однозначного мнения о пропорциях между ауто- и ксенографтом: кто-то рекомендует 50/50, другие склоняются к 30/70 и т. д.
На деле всё проще. Особенно, если знать, что происходит с аутокостной стружкой после того, как наложены швы.
Аутокостная стружка как бы «имитирует» более обширное, чем на самом деле есть, повреждение костной ткани.
По сути, она провоцирует постоперационное воспаление, тем самым стимулируя регенерацию костной ткани. Следовательно, чем больше аутокостной стружки, тем интенсивнее будет воспалительный процесс, тем сложнее держать его под контролем. А исходом этого воспалительного процесса будет более значительная резорбция графта и, как следствие, ухудшение результата лечения. В общем, не нужно фигачить костной стружки «от души», полагая, что «чем больше, тем лучше».
Намного правильнее подбирать долю аутокостной стружки в графте индивидуально, соразмерно клинической ситуации. Например, она может составлять от 0 до 50% в случае, если:
— мы имеем дело с костным ложем биотипа D1-D2
— восстанавливаемый нами костный дефект имеет минимальную, по отношению к объему, костную поверхность
— мы используем нерезорбируемые барьерные мембраны или каркасы
— пациенту больше 40 лет, и/или, вследствие хронических заболеваний, у него есть проблемы с микроциркуляцией.
И наоборот, мы можем вообще не использовать аутокостную стружку, если:
— мы работаем с многостеночным костным дефектом.
— биотип костного ложа атрофического дефекта D3-D4
Каких-то четких указаний и алгоритмов здесь нет и быть не может. Но со временем вы научитесь правильно подбирать пропорции.
Барьерные мембраны — выбор
В операции НКР барьерная мембрана играет двоякую роль. С одной стороны, она формирует каркас восстанавливаемого объема, иммобилизует и фиксирует в нем графт. С другой, изолирует графт от мягких тканей на необходимое для регенерации кости время.
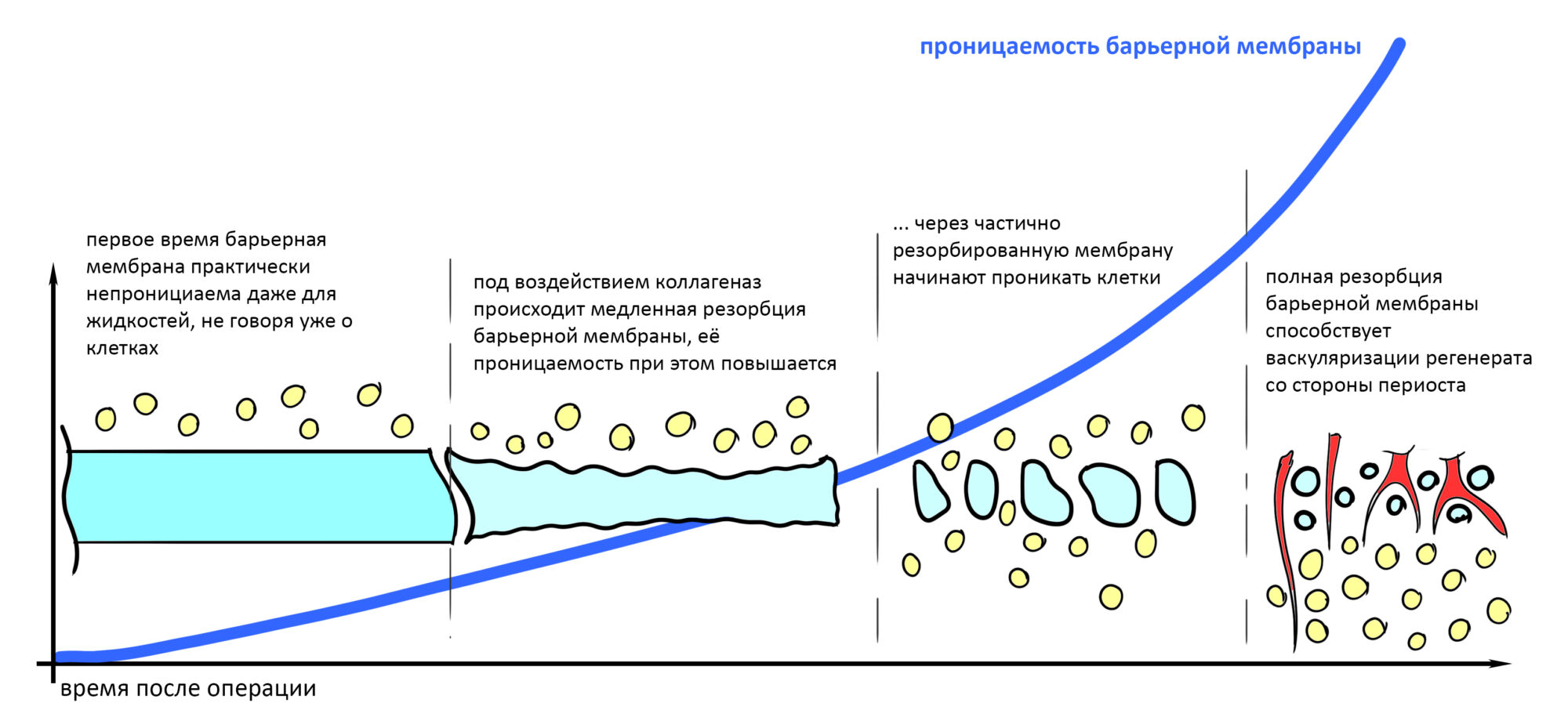
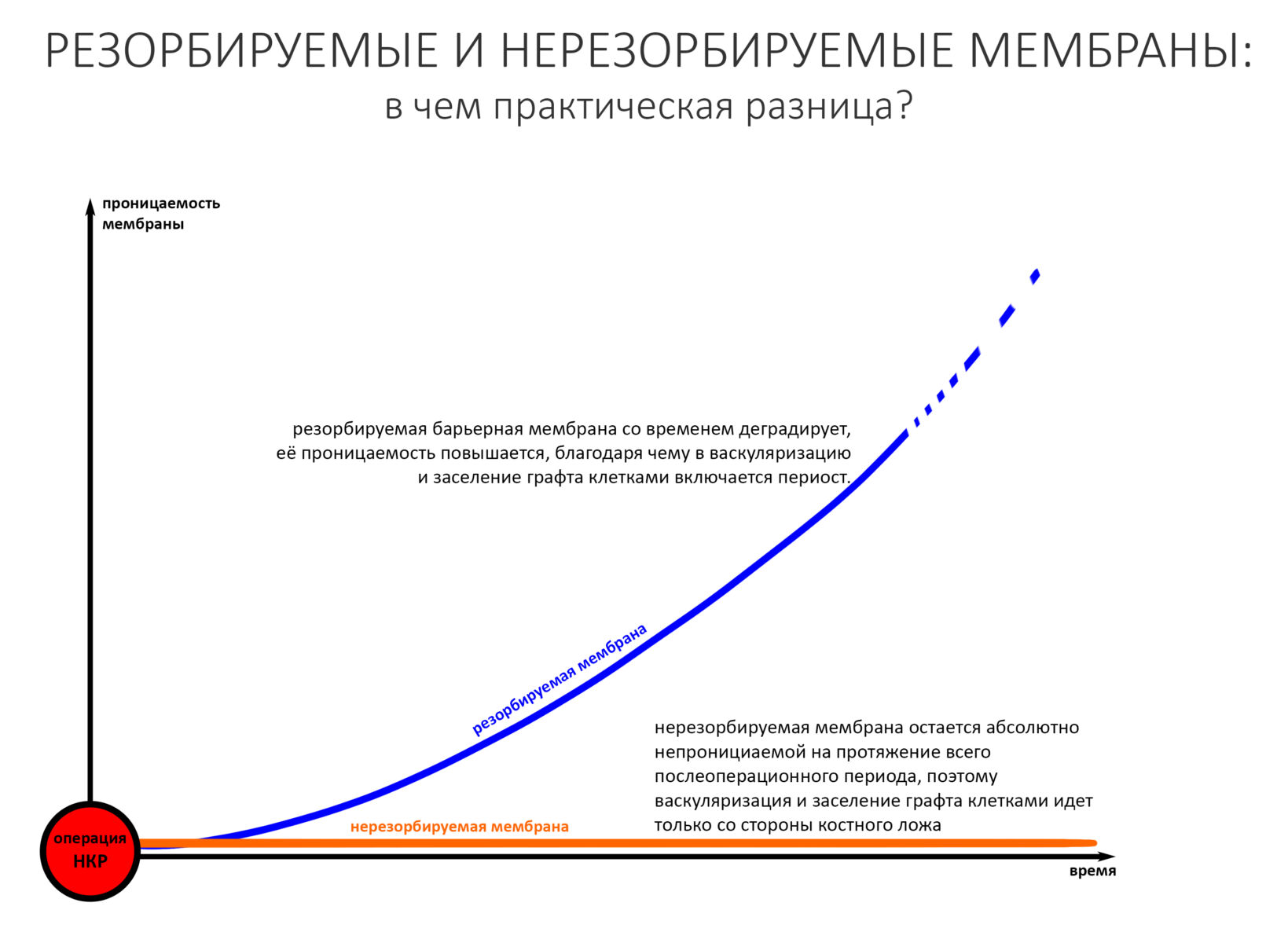
Как я уже отмечал выше, барьерные мембраны можно разделить на нерезорбируемые и резорбируемые. Что интересно, во время и короткое время после операции все барьерные мембраны более-менее непроницаемые. Иногда — даже для жидкости. Затем под действием ферментов резорбируемые барьерные мембраны деградируют, их проницаемость повышается. В какой-то момент она становится достаточной для того, чтобы в васкуляризацию графта включился периост, и из него в область дефекта поперли т. н. «спящие» фибро- и остеобласты.
Ежу понятно, что нерезорбируемые мембраны никак не деградируют, а потому периост над графтом остается «выключенным» из процесса его васкуляризации и заселения клетками.
Эта разница в поведении накладывает существенный отпечаток на особенности использования барьерных мембран разных типов:
1. Резорбируемые мембраны более удобны, но нельзя предсказать сроки их деградации. Они зависимости от ферментной активности, в частности от активности коллагеназ. Если барьерная мембрана резорбируется раньше времени, то мы потеряем результат, частично или целиком. И наоборот, нерезорбируемые барьерные мембраны могут изолировать и удерживать графт продолжительный период времени, на них не действуют ферменты. Они стабильны и устойчивы, особенно если имеют армирование или используются с каркасом, а потому более предпочтительны для пластики обширных костных дефектов.
2. Своевременное вовлечение периоста в процесс заживления, ускоряет процесс регенерации, поскольку прорастание сосудов и миграция клеток в графт идет со всех сторон. Средний срок ожидания после НКР с использованием резорбируемых мембран — не более 5 месяцев. В случае использования PTFE-мембран, миграция клеток и васкуляризация идут только со стороны костного ложа на протяжение всего межэтапного периода, это существенно увеличивает сроки регенерации — вплоть до 7-9 месяцев.
3. Резорбируемые мембраны не нужно удалять, достаточно освободить пространство под имплантаты от пинов или винтов. Не нужно раскрывать рану, отслаивать периост с регенерата и т. д., можно обойтись небольшим разрезом в проекции лунок будущих имплантатов. Честно говоря, с нерезорбируемыми мембранами и даже с каркасными сетками можно поступить также, но обычно все рекомендуют их удалять, что значительно усложняет последующую операцию имплантации.
Другими словами, не стоит сравнивать глобальную эффективность резорбируемых и нерезорбируемых барьерных мембран. Наилучшие результаты дает применение нужной мембраны в подходящем клиническом случае, в то время как в другой клинической ситуации выбор может быть совершенно иным — и тоже правильным.
Чего бы я категорически рекомендовал избегать в работе? Моё мнение в этом вопросе, возможно, будет субъективным, но:
— я не рекомендую использовать барьерные мембраны, полученные путем лиофилизации перикарда, твердой мозговой оболочки, стенки кишечника летучей собаки и т. д.
— я опасаюсь использовать в обширных работах полилактидные (полисахаридные) мембраны. Те, что называют «мембранами длительной резорбции».
— если вы работаете с новым для себя биоматериалом, сначала испытайте его свойства in vitro, не на пациенте. Так вы убережете себя от неожиданностей во время хирургической операции.
В остальном, рынок биоматериалов достаточно разнообразен, на нем представлено множество достойных продуктов, в т. ч. российского производства. Можно выбирать на любой вкус, цвет и кошелек.
Этапы операции
Далее мы поэтапно рассмотрим основные этапы операции остеопластики методом НКР.
Ремарка. Поскольку я ставлю целью изучение этапов НКР, то для наглядности выбирал картинки из разных клинических случаев.
Проще говоря, здесь я покажу вам не одну хирургическую операцию, а этапы разных НКР.
Итак, нам дано: есть пациент, есть какой-то костный дефект какой-то челюсти. Пациент обследован, план операции составлен, принято решение об остеопластике методом НКР.
0. Анестезия
В сравнении с другими видами остеопластики, НКР минимально травматична, потому в 99,991% случаев может быть проведена под местной анестезией. И тут дело даже не в том, что в амбулаторной стоматологии наркоз используют только мудаки. Взаимодействие и контакт с пациентом во время операции существенно облегчают её проведение.
Поэтому исключительно местная анестезия. Чаще всего достаточно инфильтрационной анестезии — мы же вглубь кости не полезем, верно?
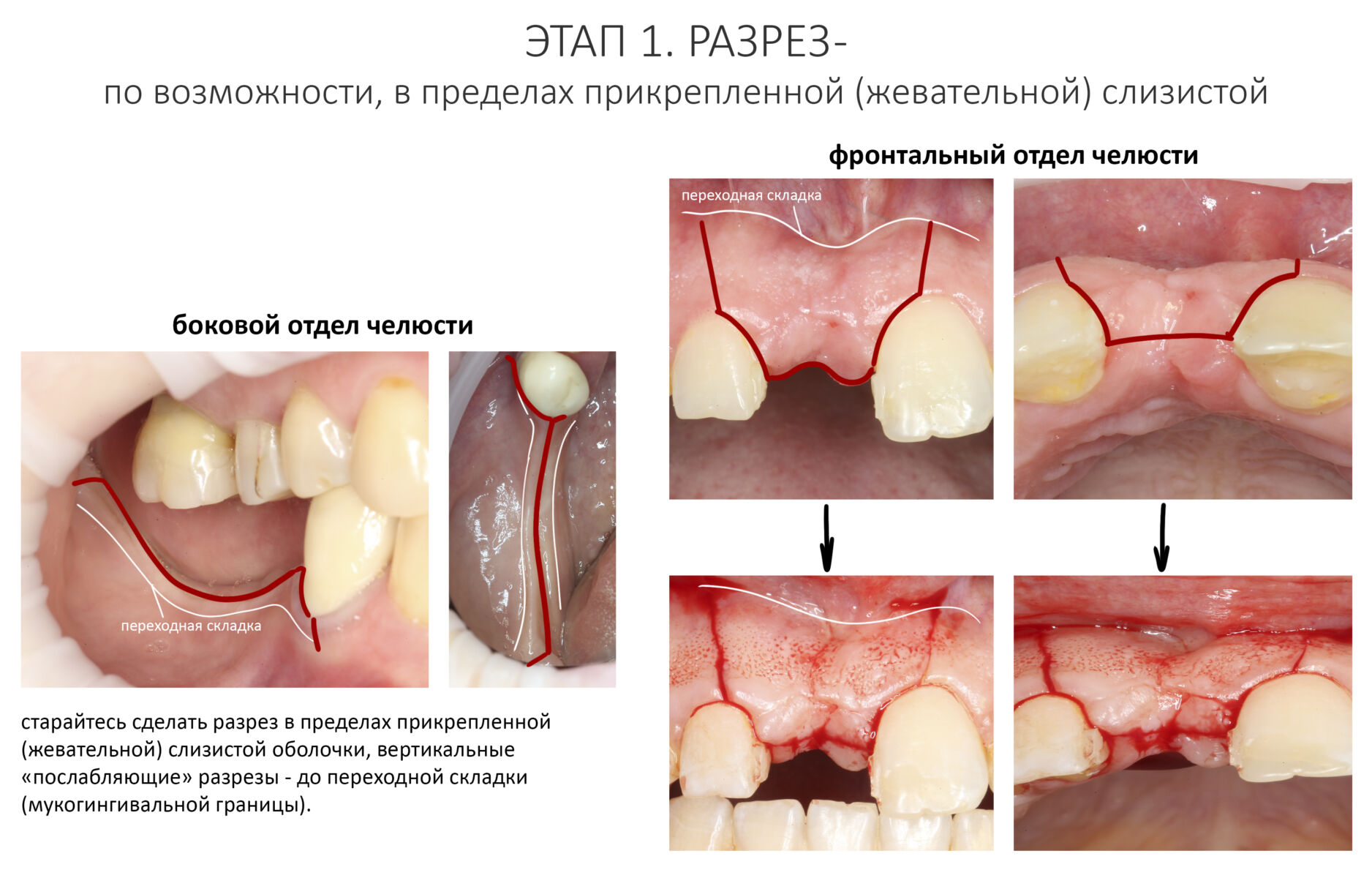
1. Разрез
Старайтесь сделать разрез в пределах жевательной слизистой оболочки (кератинизированной) десны. Для более широкого раскрытия, что иногда требуется для фиксации мембраны, можно сделать послабляющие вертикальные разрезы: для включенных дефектов их лучше вести от зенита соседних зубов до переходной складки или чуть ниже, а для концевых — в произвольном порядке и тоже до переходной складки или чуть ниже.
Планируя разрез заранее думайте, как будете его ушивать. Жевательная слизистая намного лучше держит нить и меньше прорезается, нежели выстилающая. Разрезы в пределах подвижной слизистой оболочки лучше свести к минимуму.
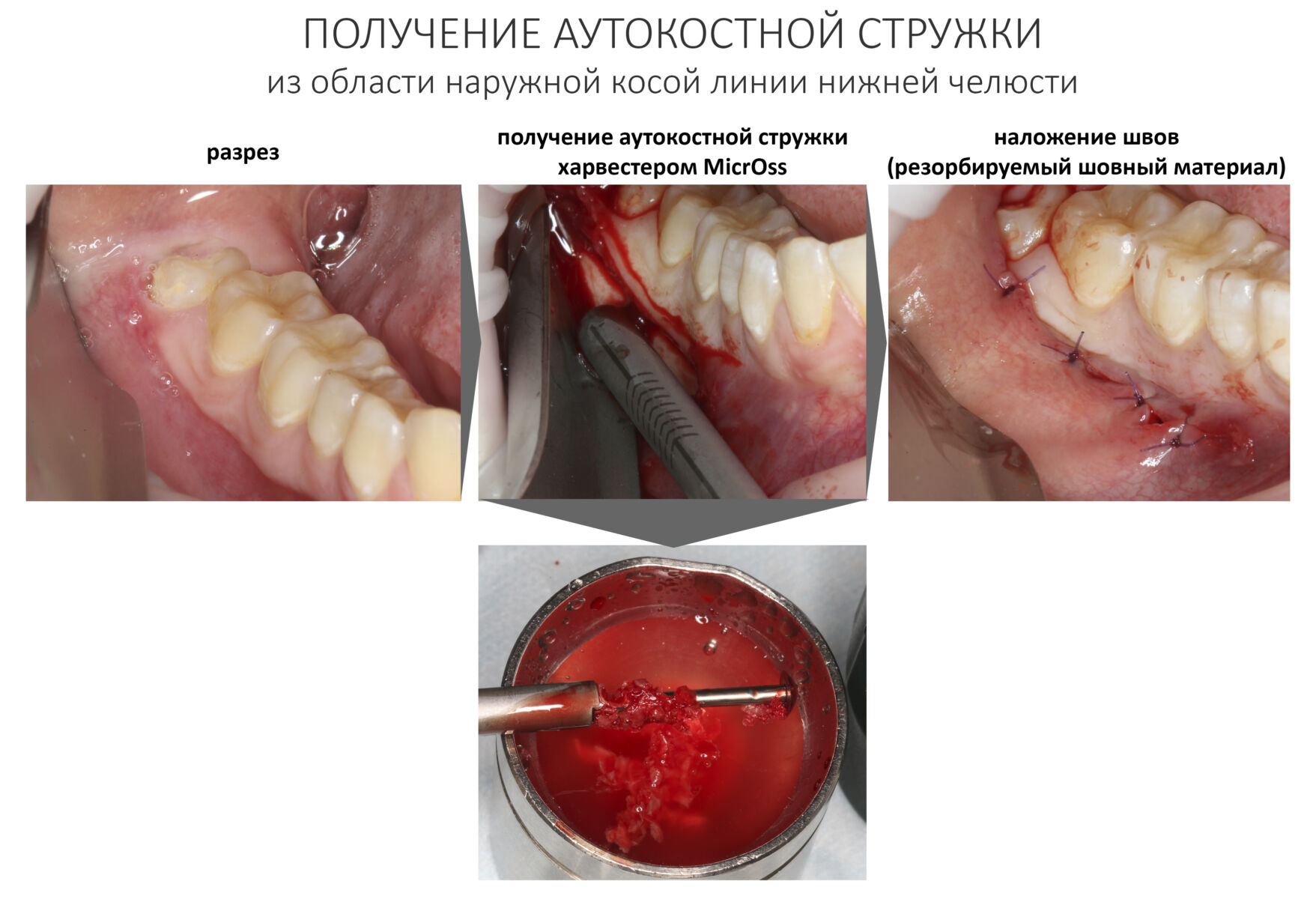
2. Забор костной стружки и создание микса для трансплантации
Наиболее удобное и комфортное место для получения аутографта — это наружная косая линия нижней челюсти.
Другие области имеет смысл использовать только в случае операции по принципу «одной раны», т. е. когда забор аутографта происходит прямо из костного дефекта или по близости от него.
Как я уже писал выше, для получения аутокостной стружки мы используем остеохарвестер (костный скребок) MicrOss. Работа с ним требует определенных навыков, для начала лучше потренироваться на чем-нибудь подходящем.
Полученную аутокостную стружку поместите в чашку с физиологическим раствором, добавьте ксенографт в нужной пропорции (см. выше).
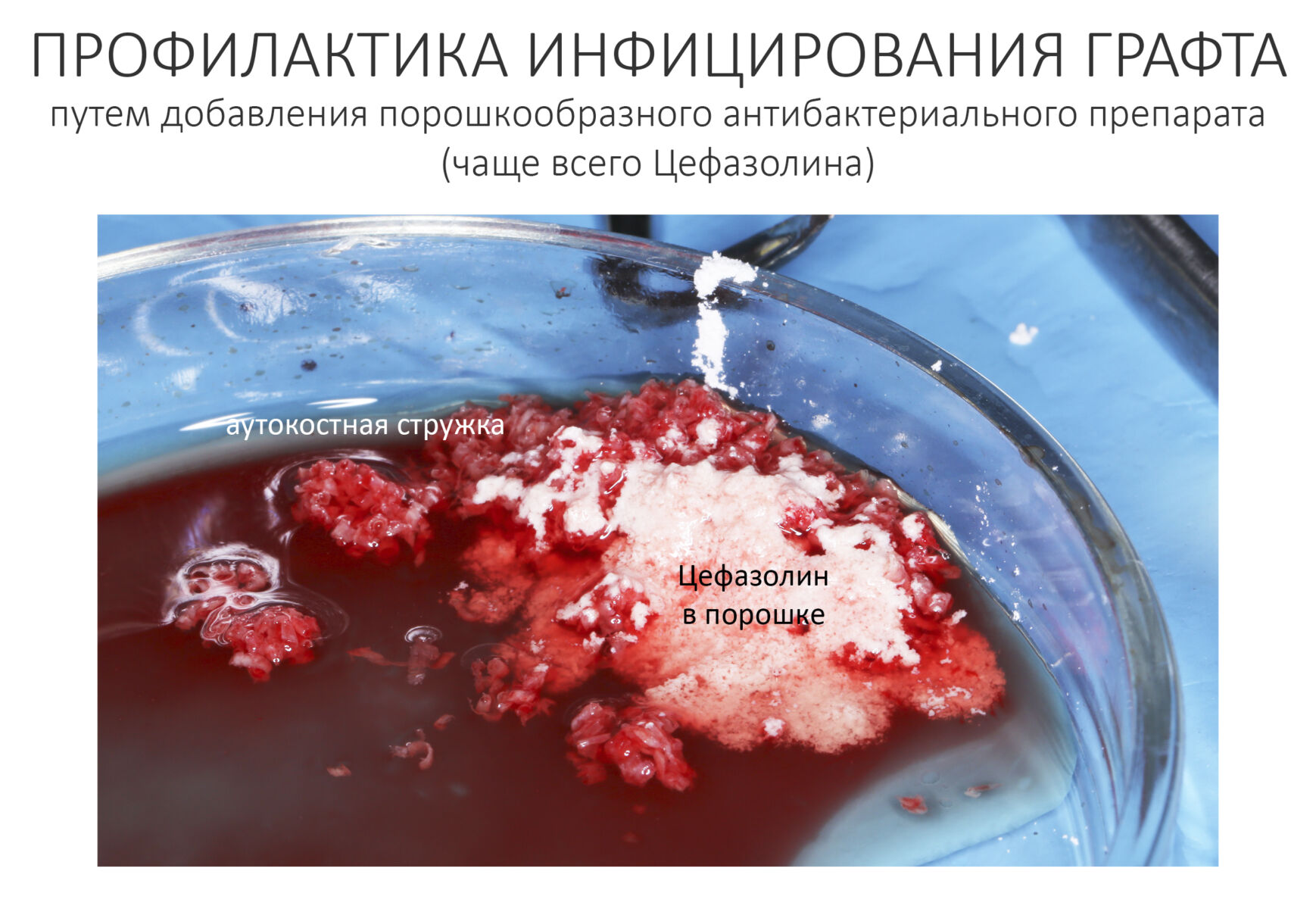
Перемешайте, уберите лишнюю жидкость. В получившийся микс можно добавить небольшое количество порошкообразного антибиотика (мы используем Цефазолин), это имеет смысл в ситуациях, когда вы не уверены в чистоте операционной раны.
Прежде, чем мы перейдем к следующим этапам хирургической операции, я должен заметить, что с этого момента для хирурга начался обратный отсчет. Чем дольше микс находится в чашке, тем больше он инфицируется, тем хуже будет прогноз по результату хирургической операции, поэтому этапы 3 и 4 должны быть проведены как можно быстрее.
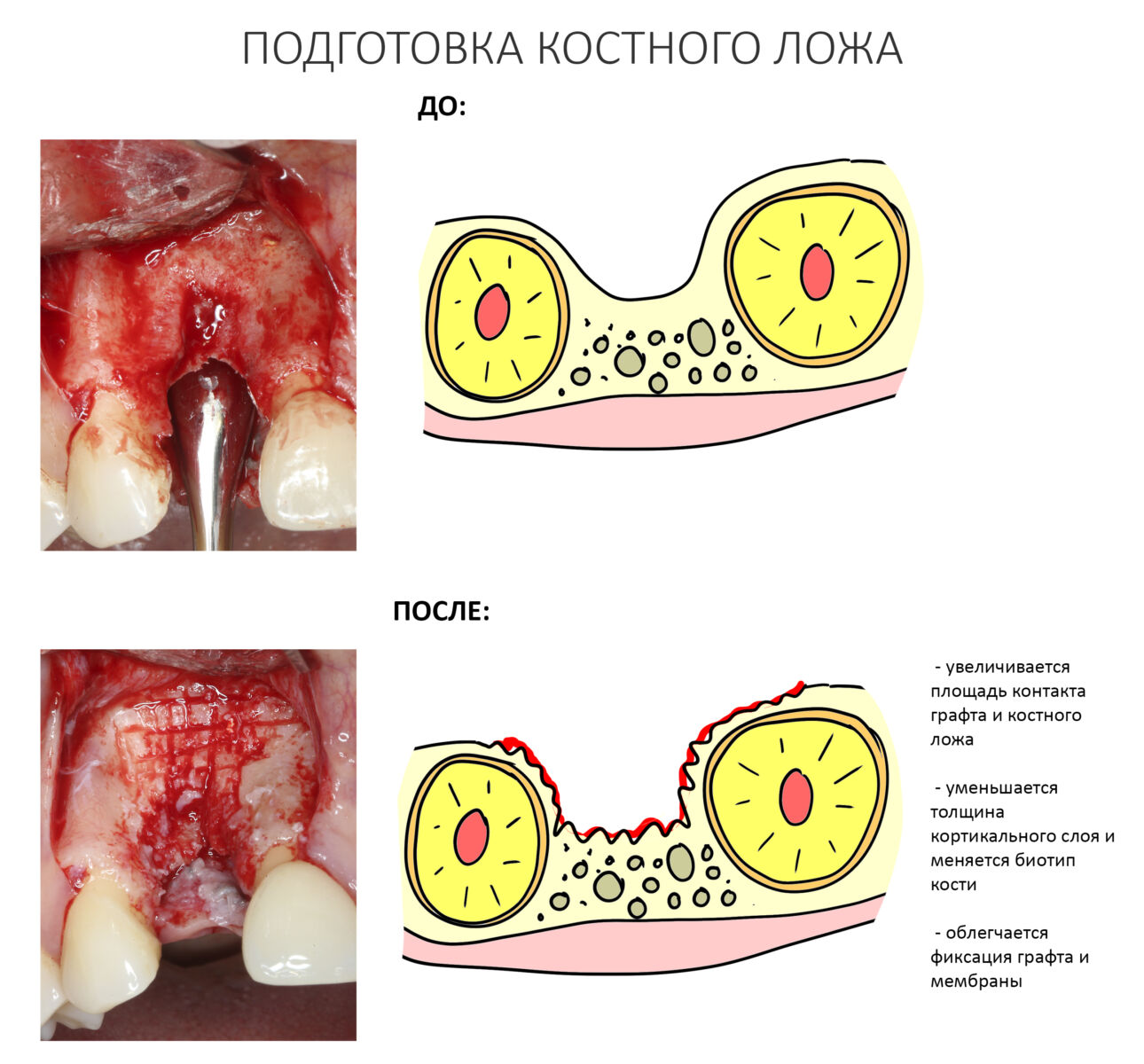
3. Подготовка костного ложа
Если забор аутокостной стружки осуществлялся с поверхности костного дефекта, то этим этапом можно пренебречь. В остальном он жизненно необходим для успеха остеопластики.
Для меня странно, но это как раз тот этап, которому по неизвестной мне причине уделяют минимальное внимание. Чаще всего, подготовку костного ложа игнорируют или ограничиваются сверлением десятка отверстий — точь-в-точь как Урбан показывал на лекции. Потому удивляются, почему метод НКР «не работает».
Между тем, это один из важнейших этапов при реализации любого метода остеопластики. С помощью него достигают целого ряда положительных эффектов:
— увеличивают площадь контакта графта с костью
— путем сошлифовывания, превращают кость биотипа D1-D2 в D3-D4.
— создают условия для удобной установки пинов и/или винтов.
— не дают сместиться уложенному графту
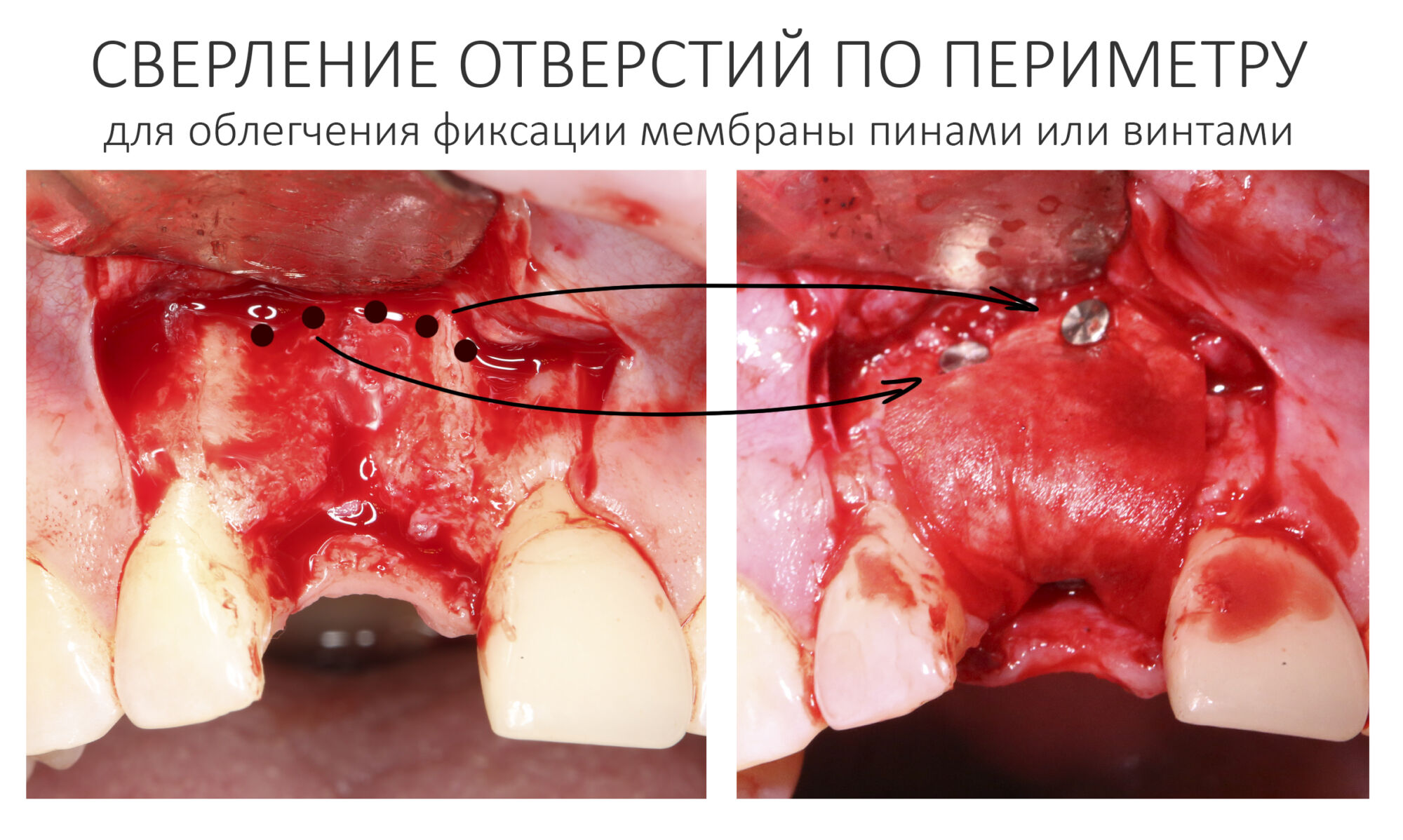
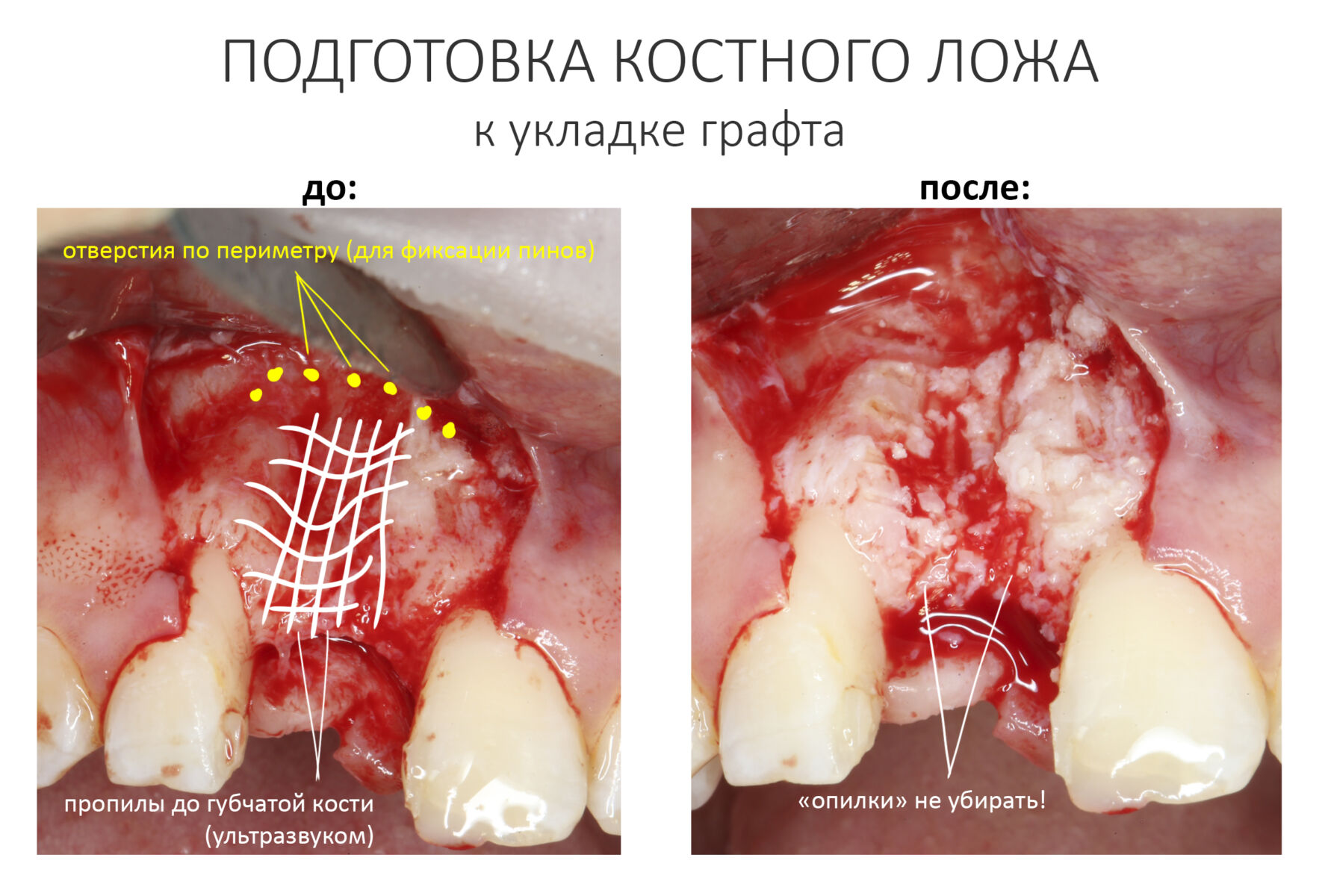
Самый мудацкий способ подготовки костного ложа — это сверление отверстий. Почему мудацкий? Потому что из всех вышеперечисленных эффектов достигается лишь один — действительно, в насверленные отверстия можно наколотить пинов. Но в этом случае их стоит сверлить по периметру дефекта, как раз с расчетом на последующие пины или винты. Иногда мы так и делаем:
Правильная подготовка костного ложа осуществляется с помощью ультразвуковой хирургической системы или прямого наконечника с шариковым твердосплавным бором. С помощью них мы аккуратно сошлифовываем слой кости. Какой? Такой, чтобы начала просвечивать губчатая костная ткань, и чтобы из кости началось капиллярное кровотечение. Я рекомендую делать шлифовку максимально рельефной — это увеличит площадь контакта кости с графтом. При использовании ультразвука, мы параллельными и пересекающимися бороздами (глубина произвольная) создаем что-то вроде сетки:
Этого достаточно. Как только результат этапа достигнут, можно переходить к следующему, укладке графта и фиксации барьерной мембраны. Но в обратном порядке.
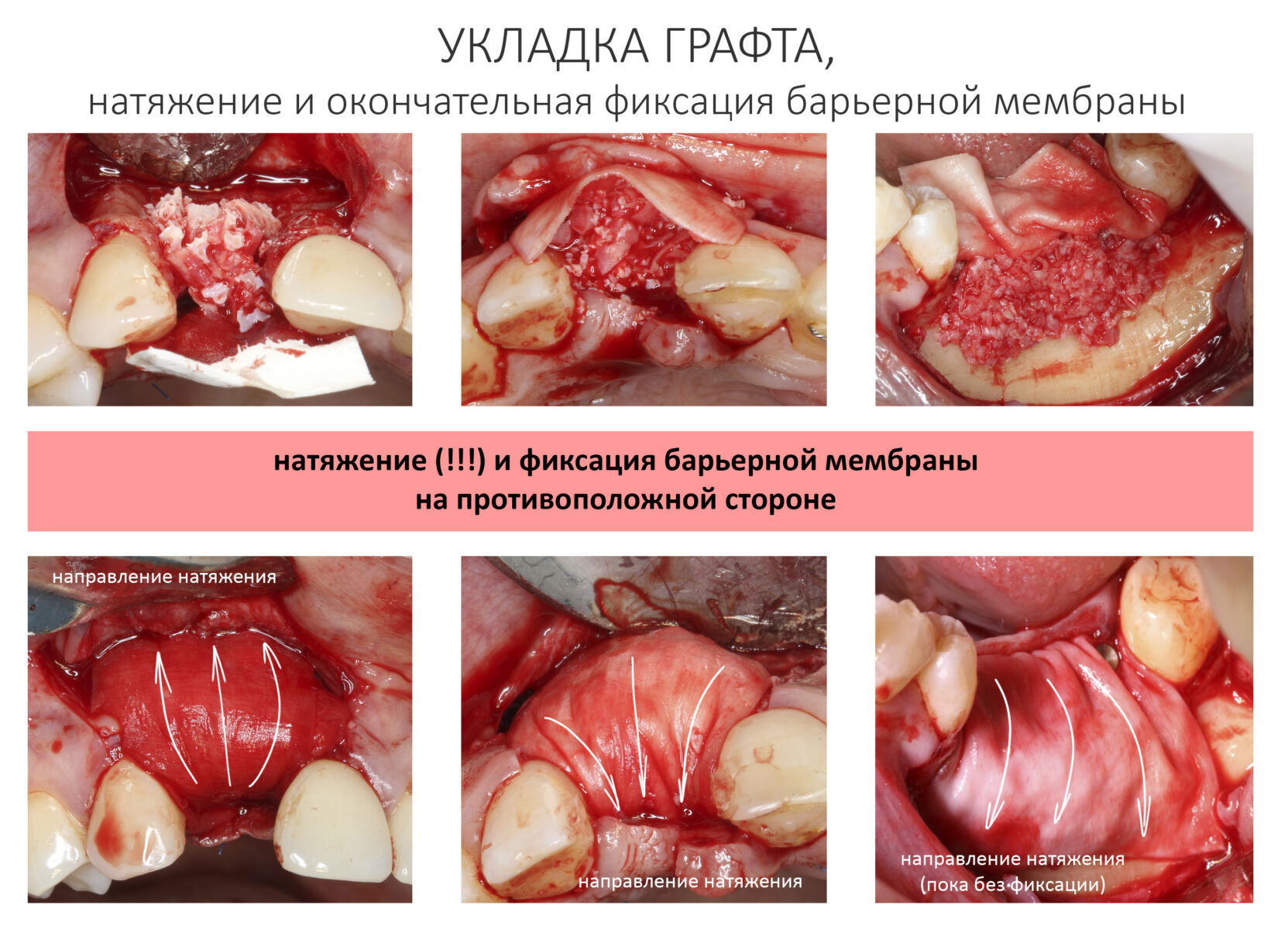
4. Фиксация барьерной мембраны и укладка графта
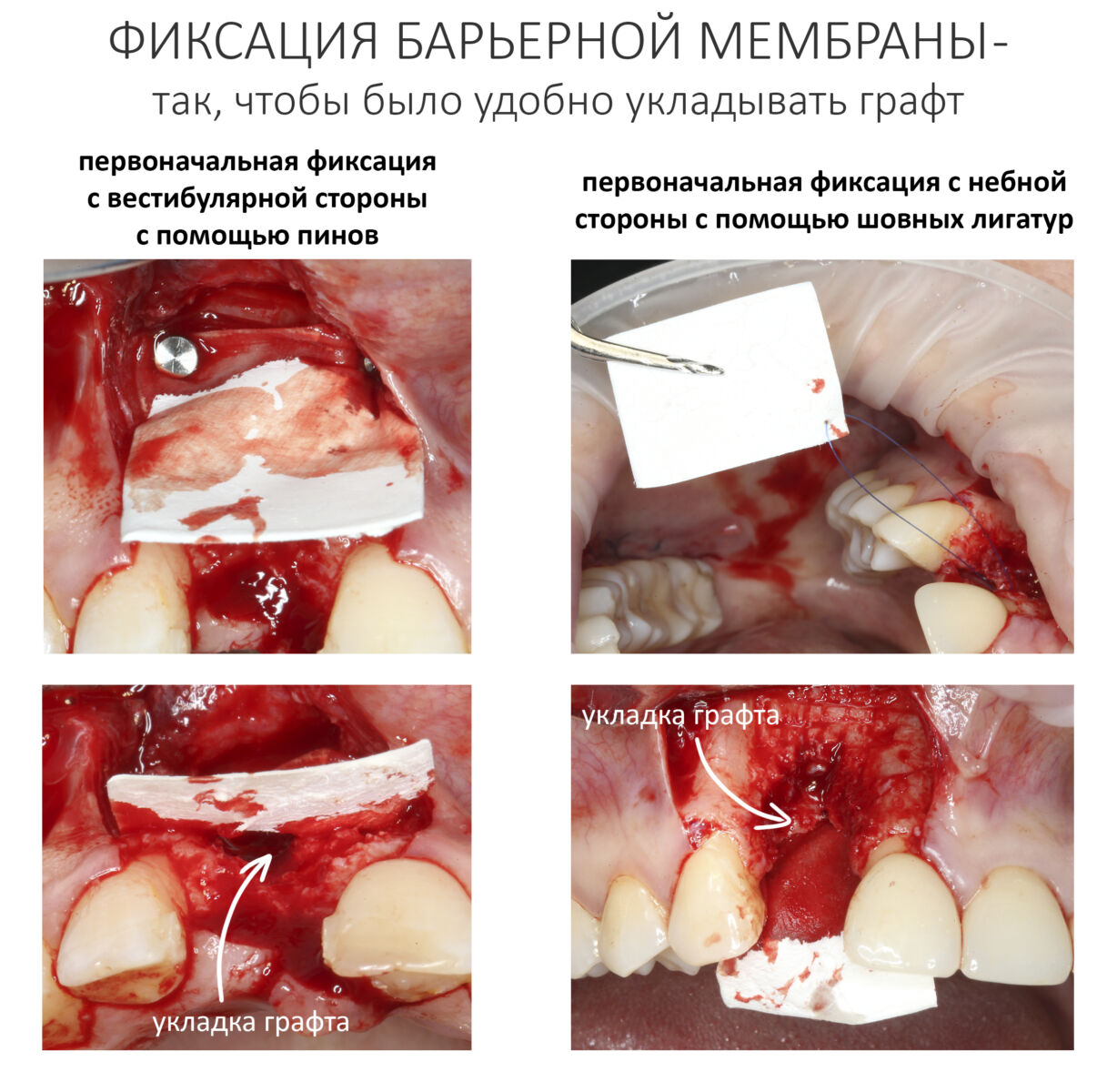
Прежде, чем укладывать графт в область костного дефекта, я рекомендую частично зафиксировать барьерную мембрану. Обычно мы делаем это с помощью пинов или винтов. В труднодоступных местах можно использовать шовные лигатуры (см. выше). Фиксируйте таким образом, чтобы создать условия для аккуратной укладки графта и последующего натяжения барьерной мембраны. Можно начать как с вестибулярной, так и с язычной (небной) поверхности — главное, чтобы было удобно.
Если есть удобный доступ, можно использовать пины или винты.
Для облегчения процесса, я обычно заранее делаю несколько отверстий самым маленьким сверлом в том месте, куда планирую вколотить пин или вкрутить винт. Почему несколько? Потому что через мембрану отверстий не видно, и шансов вслепую попасть в одно из подготовленных отверстий значительно прибавляется. Если вы работаете в D1-D2 биотипах (что наиболее вероятно), то без заранее подготовленных отверстий под пины или винты вообще невозможно обойтись.
Особую осторожность следует проявлять при фиксации мембраны винтами. Мембрану стоит прижать к кости и удерживать, чтобы не допустить её наматывания на вращающийся винт.
Важная ремарка! Нельзя сверлить отверстия через барьерную мембрану, их нужно подготовить заранее.
После первичной фиксации проверьте, выдержит ли мембрана натяжение.
Затем можно приступить к укладке графта. Это простой этап, я не думаю, что у кого-то с ним возникнут проблемы.
При должном навыке он занимает меньше минуты.
После переходим к самому ответственному этапу — необходимо обеспечить неподвижность графта с помощью барьерной мембраны. Для этого мы буквально натягиваем её на графт, по максимуму используя её эластичность. Натянутую барьерную мембрану также фиксируем с помощью пинов или винтов.
Показателем правильности выполнения этой процедуры является неподвижность и твердость графта под барьерной мембраной. Аккуратно надавите на него пинцетом или другим инструментом — графт под барьерной мембраной не должен продавливаться или двигаться. При необходимости, снова натяните мембрану и поставьте дополнительные пины или винты.
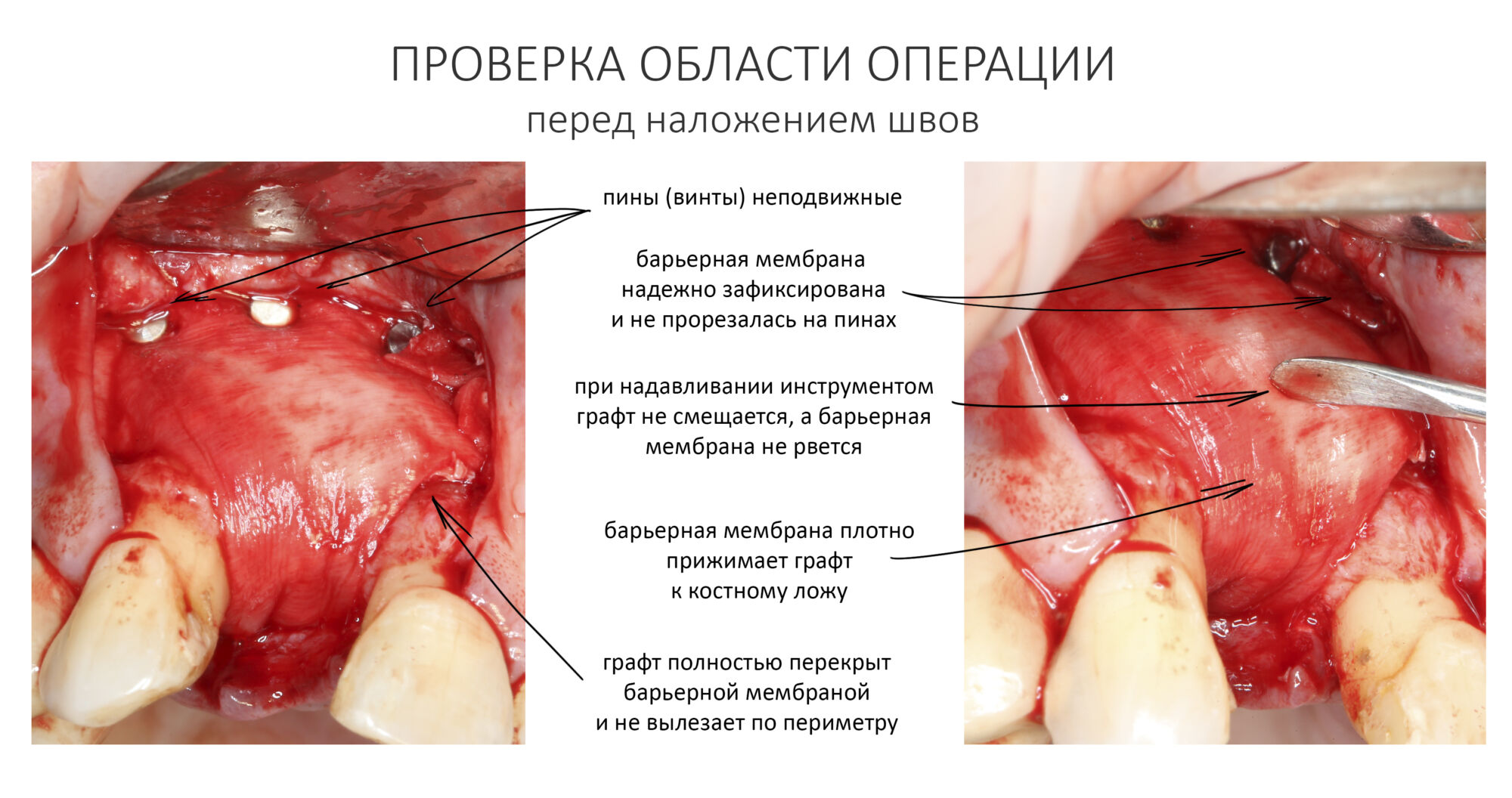
Теперь нужно всё проверить.
1. Графт должен быть герметично закрыт барьерной мембраной. По бокам не должно быть щелей, разрывов и других повреждений.
2. Нет ничего страшного в том, что барьерная мембрана образует складки. Если при этом она неподвижно фиксирует графт и не дает ему смещаться — никаких проблем.
3. То, что в некоторых местах барьерная мембрана накладывается на корни зубов — не проблема. Главное, чтобы она не торчала из операционной раны после наложения швов.
Операция практически завершена. Осталось всё это дело герметично зашить.
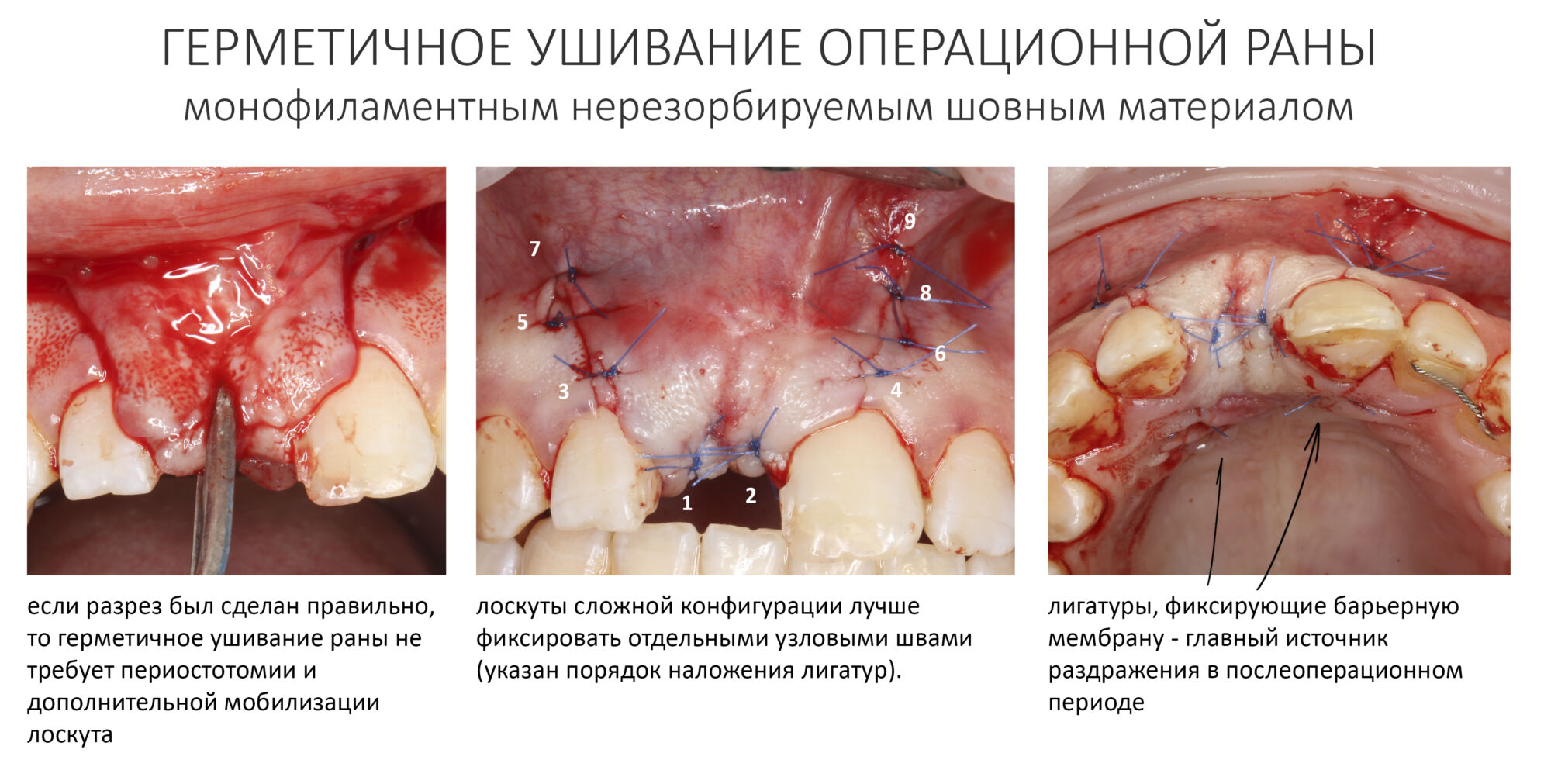
5. Наложение швов
Для наложения швов я рекомендую использовать только нерезорбируемый монофиламентный шовный материал. Исключение — область забора аутокостной стружки, если она представляет из себя отдельную рану. Там можно использовать любой шовный.
Если ранее был правильно проведен разрез, то с наложением швов нет никаких проблем. Чаще всего, мобилизация краев раны путем рассечения периоста не требуется, рана легко и просто ушивается без излишнего напряжения. В других случаях, что регулярно бывает при повторных операциях (рубцы ухудшают эластичность слизистой), можно сделать периостотомию, но таким образом, чтобы рассечение периоста оказалось как можно дальше от восстановленного костного дефекта:
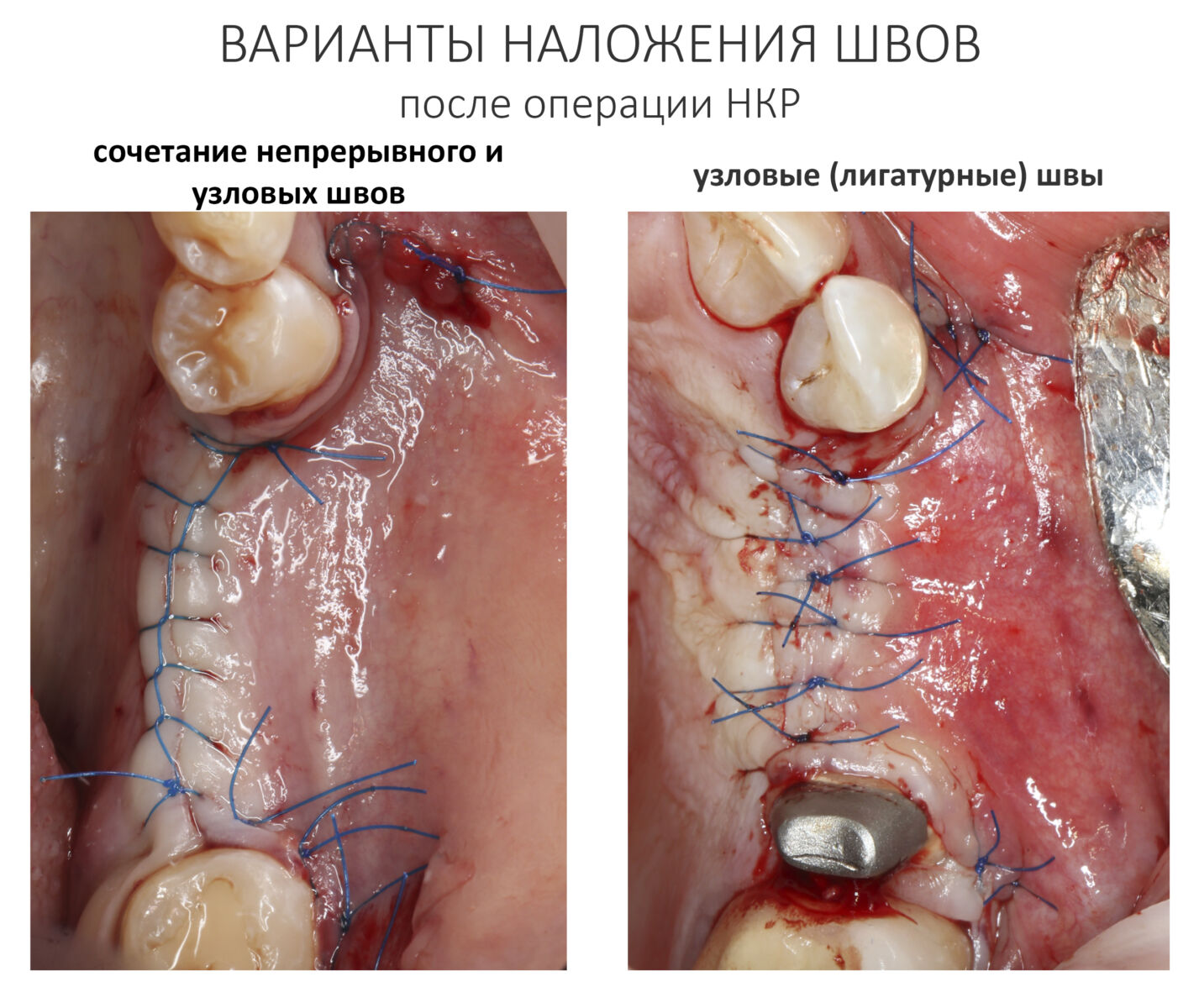
Ушивать рану можно как отдельными узловыми лигатурными, так и непрерывным швом, также можно сочетать эти варианты:
После наложения швов стоит проверить рану на герметичность. Если всё хорошо, то она практически не кровоточит.
6. Контроль
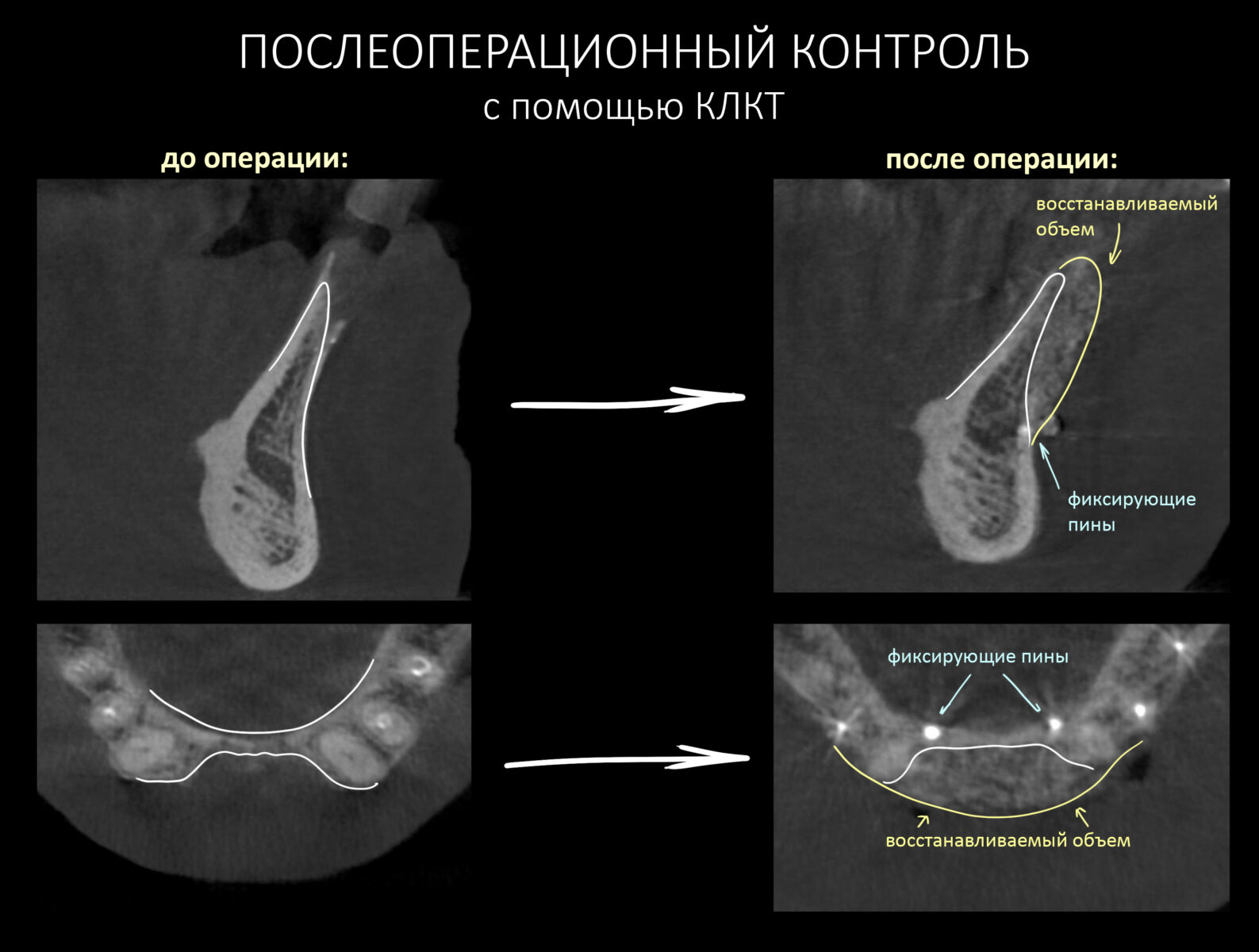
Для послеоперационного контроля мы используем конусно-лучевую компьютерную томографию:
По КЛКТ обращаем внимание на структуру графта, его положение, форму восстановленного костного дефекта. В дальнейшем по изменению рентгенологической прозрачности графта мы будем судить о формировании регенерата.
Рекомендации и назначения
Рекомендации после НКР точно такие же, как после других остеопластических операций, в этом плане методика не оригинальна. Посмотреть их с пояснениями и даже скачать бланк с рекомендациями для пациентов можно на сайте Уютной КЛИНИКИ ИН. Собственно, ничего нового: холод, голод, покой…
Я же хотел бы обратить внимание на лекарственную терапию. Честно говоря, мне здесь приходится повторяться, но повторение, как говорится, мать учения.
Запомните, что отек (даже значительный) области операции, кровотечение (геморрагия в слизистую и кожу), незначительные болезненные ощущения после операции НКР — это нормально. Это обычные симптомы обычного постоперационного воспалительного процесса. С него начинается регенерация. Если заняться активным подавлением постоперационного воспаления, можно ненароком задавить и регенерацию. И потом удивляться, почему ничего не получилось.
Задачей всех рекомендаций и назначенной лекарственной терапии является не подавление воспаления, а удержание его под контролем. А также профилактика инфекционных осложнений воспаления. Поэтому нельзя колоть в область операции глюкокортикостероиды. Нельзя злоупотреблять противовоспалительными препаратами, в т. ч. нестероидными. Они подавляют воспаление, а вместе с ним — регенерацию. Если пациента не беспокоят болезненные ощущения, то от приема НПВС лучше вообще отказаться.
Что же касается антибактериальной терапии, то для неё мы используем пероральные антибиотики широкого спектра действия, желательно недефицитные и недорогие. Мы назначаем их на период в несколько дней (обычно не больше недели), в случае нормально протекающей реабилитации, немедленно отменяем.
Реабилитационный период
Сам реабилитационный период абсолютно такой же, как и после других остеопластических операций. Занимает, в среднем, до двух недель и завершается снятием швов. Следует заметить, что риск осложнений, из которых наиболее распространенным и опасным является расхождение раны и инфицирование графта, может произойти на любом сроке, поэтому пациент должен посещать профилактические осмотры даже тогда, когда всё идет, вроде как, хорошо. Кроме того, он должен оставаться на связи с доктором в режиме 24/7, поскольку оперативная реакция на возникшую проблему играет важную роль в спасении результата лечения. А вообще, лучше заранее рассказать пациенту о всех возможных проблемах и разъяснить, что выполнение всех рекомендаций и назначений, своевременная реакция на состояние послеоперационной раны и симптоматику — это его зона ответственности, и от того, насколько он серьезно к этому отнесется, будет зависеть результат лечения.
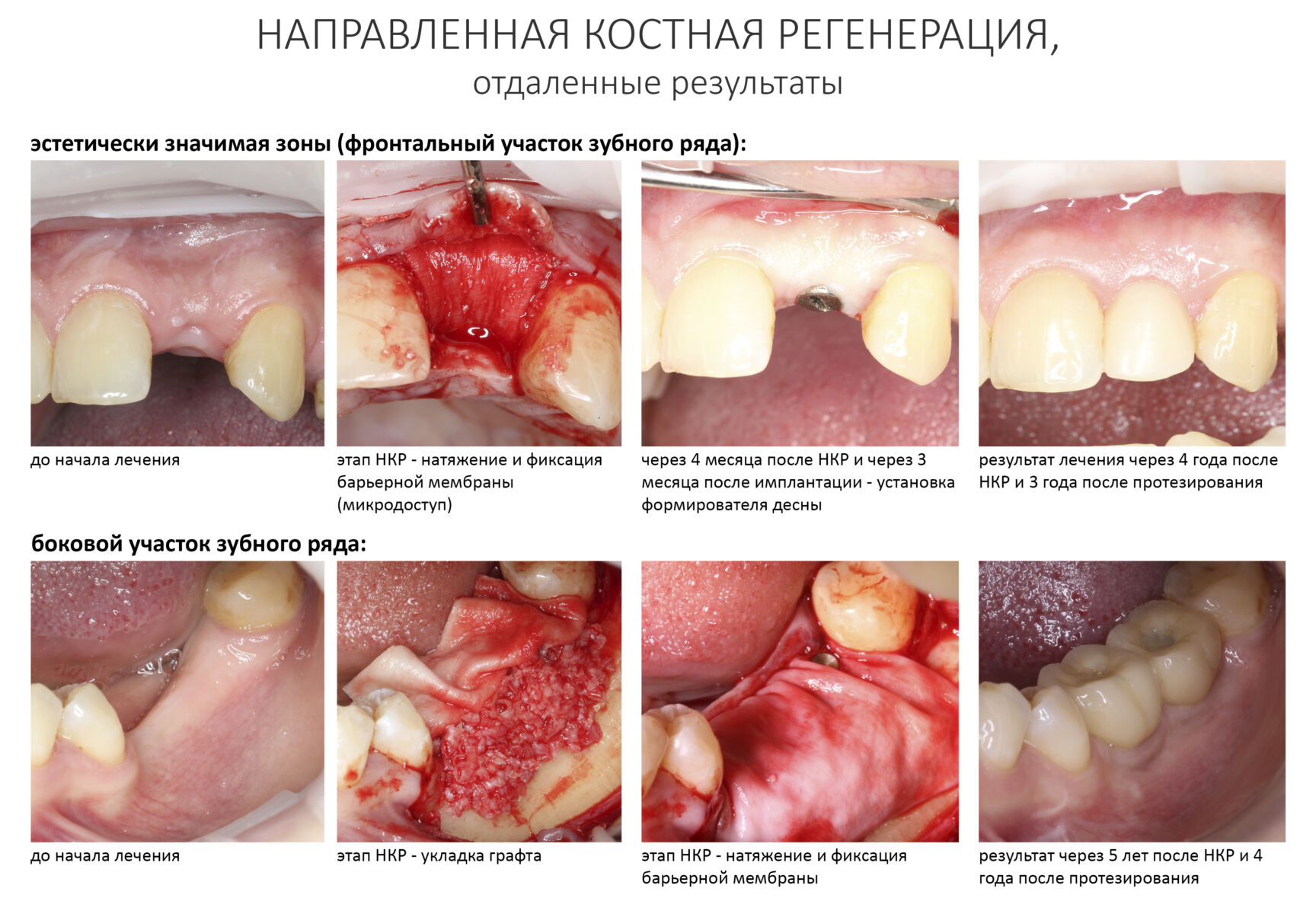
Результаты и продолжение лечения
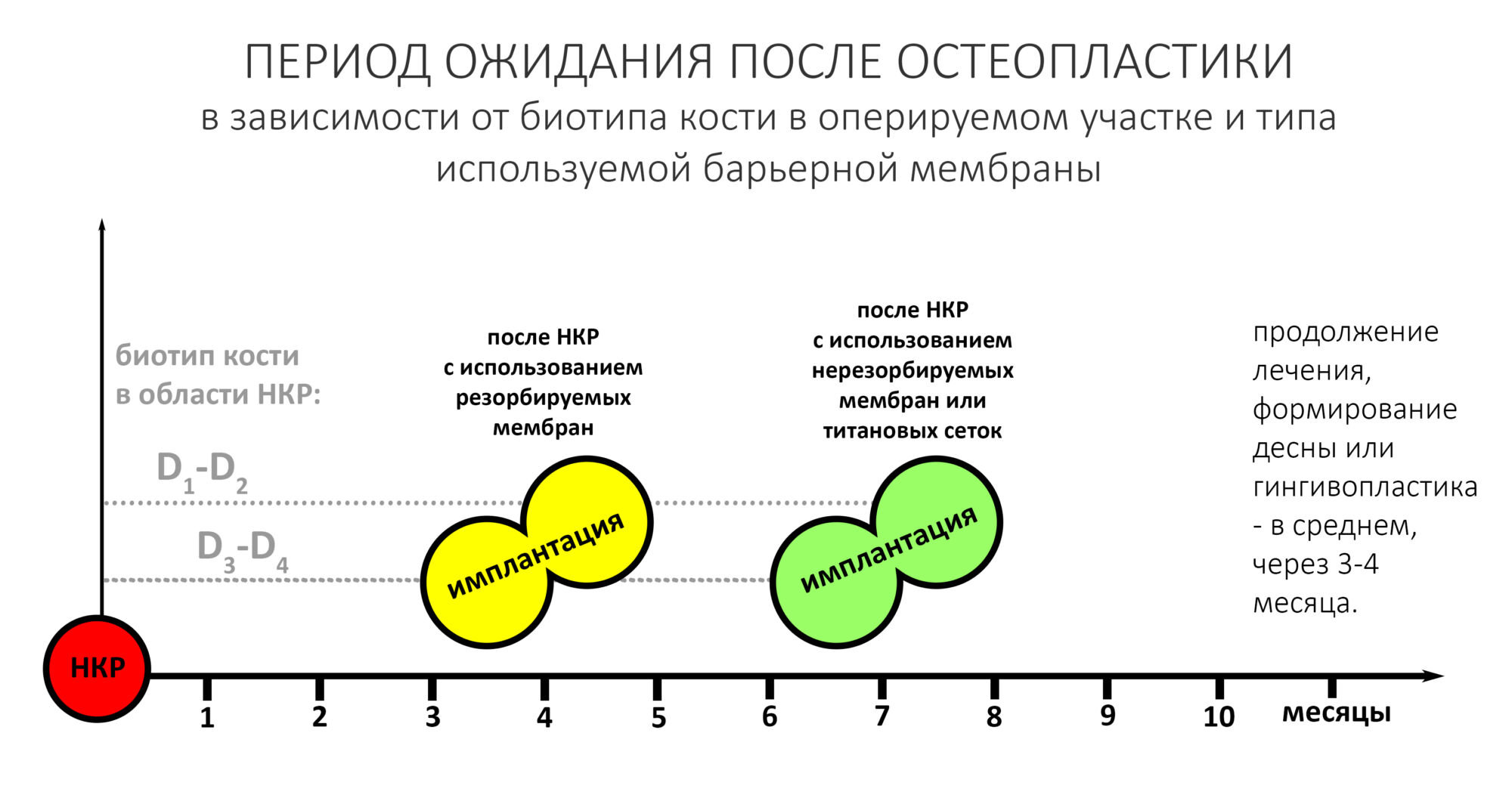
Четких и однозначных сроков восстановления костного дефекта после НКР нет. Некоторые считают достаточным срок в 4-5 месяцев, другие рекомендуют ожидать но 8-9 месяцев и даже дольше. По этому поводу на сайте Уютной КЛИНИКИ ИН есть соответствующая статья, я рекомендую прочитать>>. Между прочим, это одна из самых популярных наших публикаций.
Опять же, всё просто. Срок ожидания зависит от всё того же «предела роста», следовательно от формы и объема костного дефекта. Использование нерезорбируемых барьерных мембран (PTFE) увеличивает это время, поскольку периост над восстановленным костным дефектом вообще не включается в процесс васкуляризации графта и заселения его клетками.
Вот вам ориентировочный график для выбора момента имплантации после остеопластики методом НКР:
Проще говоря, любое ухудшение изначальных условий, вроде выраженной кортикальной пластинки костного ложа, большого дефекта и т. д. — это повод ждать дольше.
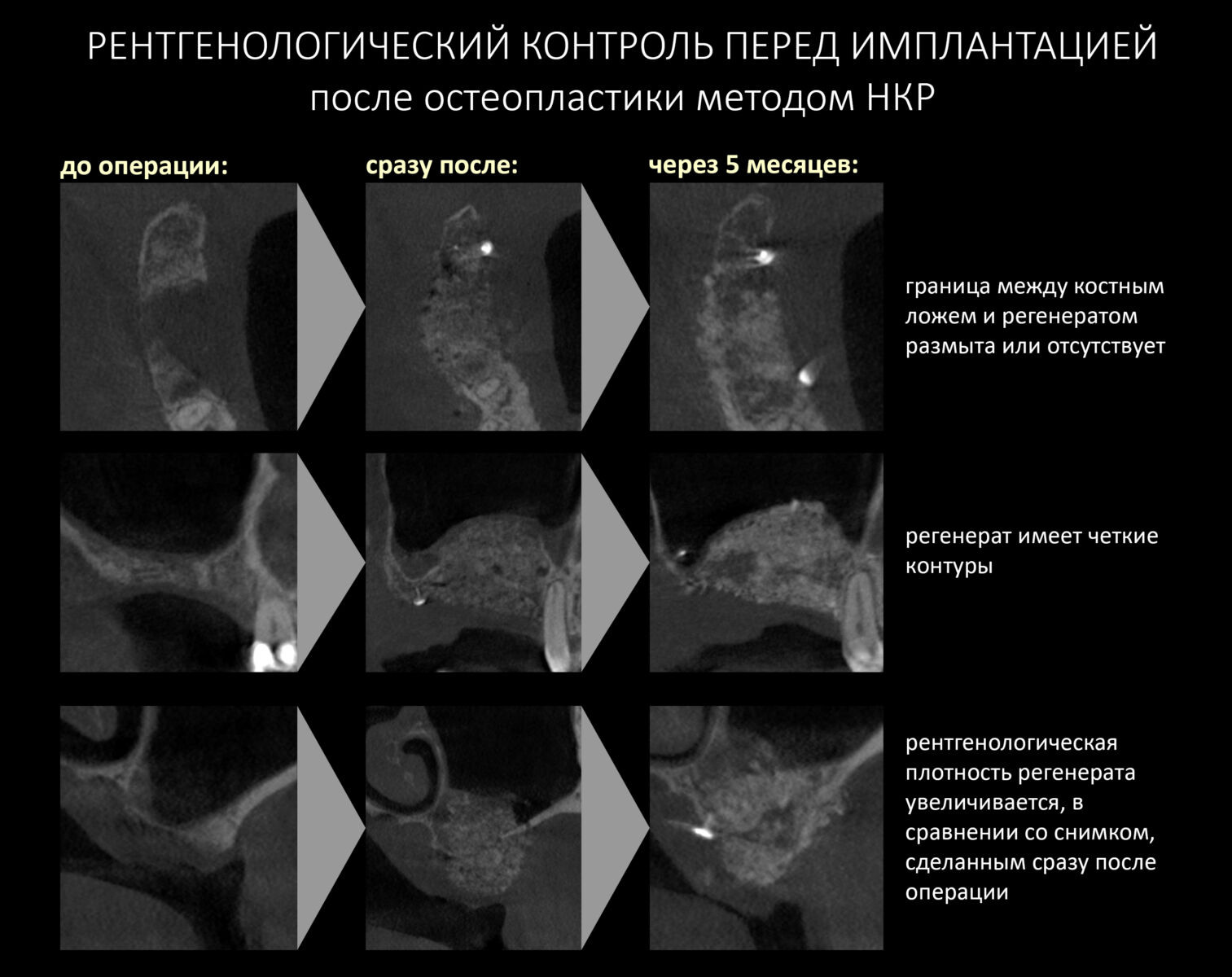
В качестве контроля перед следующим этапом лечения, имплантацией, обычно делают КЛКТ или ОПТГ. Рентгенологические признаки того, что всё удалось, следующие:
— регенерат имеет четкие округлые контуры
— он имеет более высокую рентгенологическую плотность в сравнении со снимком, сделанным после операции
— граница между регенератом и подлежащей костной тканью размыта или отсутствует.
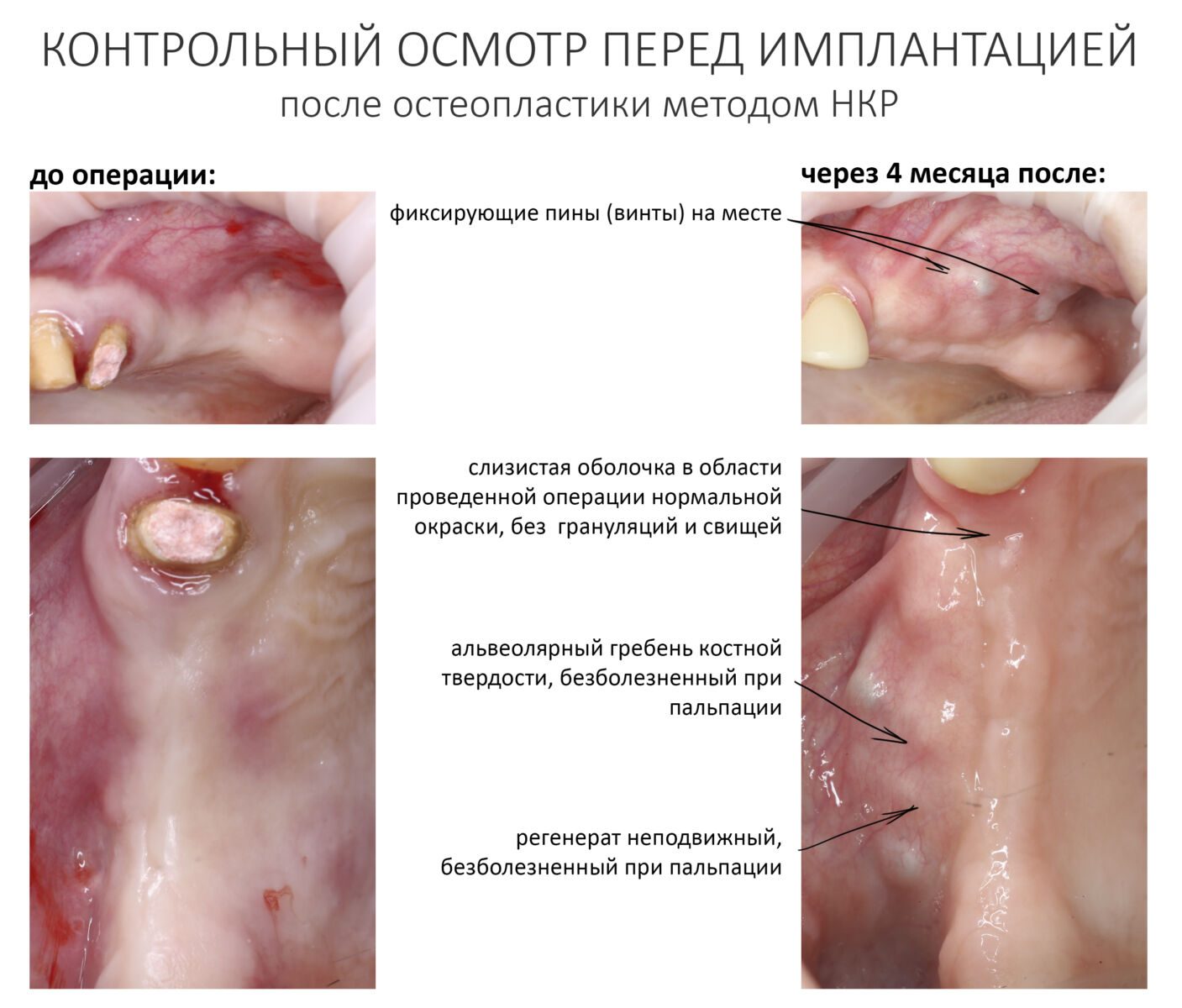
В полости рта: слизистая оболочка над регенератом и в области соседних с ним зубов не имеет свищей, пальпация области безболезненная, на ощупь регенерат твердый и неподвижный.
Если всё в порядке, можно планировать имплантацию.
Рекомендации по проведению имплантации после НКР
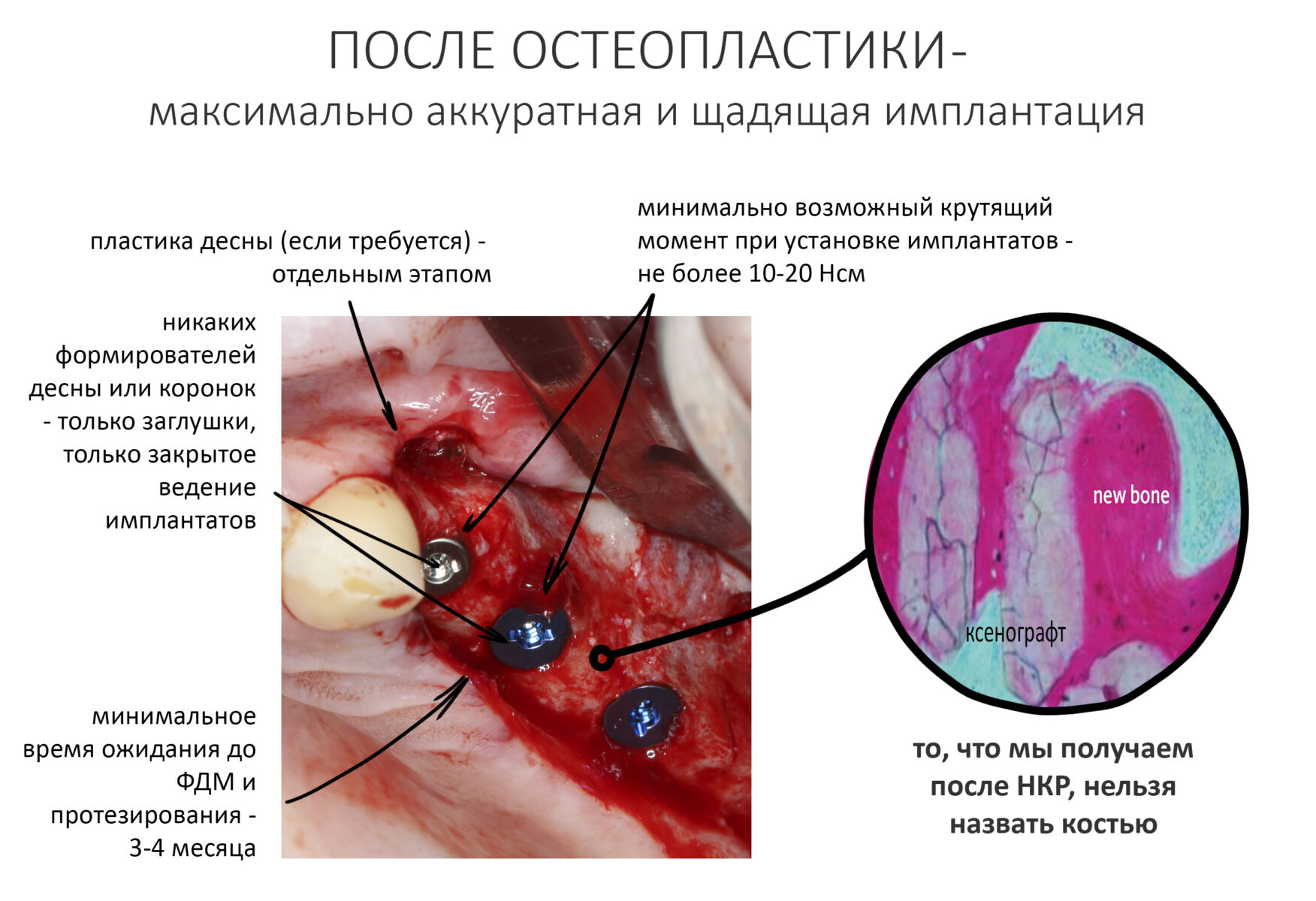
Нужно учесть то, что костный регенерат, полученный с помощью НКР — это не натуральная костная ткань в морфологическом и биологическом смысле этого слова. Его можно назвать вторичной костной мозолью (или костным рубцом) с вкраплениями минерального графта: у него нет четко выраженных кортикального и губчатого слоев, гистологической структуры с распределением остеобластов и остеоцитов, его кровоснабжение значительно отличается от микроциркуляции в естественной костной ткани. Он значительно легче инфицируется.
Поэтому обращаться с таким регенератом нужно крайне осторожно. Даже идеальный результат НКР можно запороть, если наплевательски отнестись к последующей имплантации. Таких примеров у меня масса.
Дабы не накосячить и не испортить результат шикарно проведенной остеопластики, я позволю себе дать несколько рекомендаций по дальнейшей имплантации:
— минимальные разрезы. Не нужно доставать пины или винты, если они не мешают проведению имплантации. Не надо скелетировать регенерат, который только-только «запитался» от периоста. Ваша задача — не сделать красивое фото «во, сколько наросло!», а вылечить человека и обеспечить устойчивый долгосрочный результат имплантации и последующего протезирования.
— щадящий режим препарирования регенерата под лунки. Максимум ирригации, небольшая (до 1000 об/мин) частота вращения фрезы.
— полный хирургический протокол, но лучше перепреп. Момент силы при установке имплантатов — не более 20 Нсм.
— исключительно закрытое ведение имплантатов. Никаких формирователей десны, немедленных нагрузок, протезов-в-один-день и т. д.
— срок ожидания после имплантации до следующего этапа — не менее 4 месяцев.
— пластику десны (если требуется) лучше вынести в отдельный этап, за месяц до установки формирователей десны.
Заключение
Этой публикацией я заканчиваю цикл «МЕТОДЫ ОСТЕОПЛАСТИКИ», в котором я рассказал о трех основных методах наращивания костной ткани перед имплантацией, направленной костной регенерации, аутотрансплантации крупных костных фрагментов (блоков) и остеотомии (расщеплении альвеолярного гребня). Другие варианты, обычно называемые по авторам, чаще всего являются комбинациями этих методов. В частности, уважаемая всеми остеопластика по Ф. Курри — это сочетание АТККФ и НКР. Поэтому цикл «МЕТОДЫ ОСТЕОПЛАСТИКИ» я бы назвал базовым, без которого невозможно освоение других, более сложных вариантов остеопластических операций. Писать о них не вижу смысла, поскольку доктор, уверенно работающий как с костными блоками, так и с графтом, без проблем освоит любую комбинированную методику костной аугментации.
Кстати, о докторах. Эта статья, как и две предыдущие об остеопластике, адресованы докторам. Ежу понятно, что они не заменят нормального обучения, но всё же я надеюсь, что коллеги найдут в них ответы на свои вопросы — и в итоге это поможет снизить количество косяков и ошибок, связанных с непониманием физиологических и технических нюансов наращивания костной ткани. Сегодня направленная костная регенерация — это самый популярный и распространенный метод остеопластики, потому и посвященная ему публикация получилась значительно больше, чем остальные. Надеюсь, что среди моих коллег найдутся те, кто её осилит. Тех, кто не скатился до клипового мышления и способен работать с информацией большей, чем комиксы в инстаграме, мы можем пригласить на стажировку-обучение в Уютную КЛИНИКУ ИН. Условия стажировки находятся здесь>>
А для пациентов у нас тоже есть статьи про наращивание костной ткани. Главная и самая важная из них состоит из пяти частей:
Наращивание костной ткани перед имплантацией. Что нужно знать об этом пациентам? Часть 1, Часть 2, Часть 3, Часть 4, Часть 5.
Как обычно, я рекомендую подписаться на наши каналы в Телеграме, Дзен и на страницу в ВК. И еще ЖЖ. Разумеется, если вы хотите быть в курсе новостей и следить за последними публикациями.
Как всегда, я готов ответить на все ваши вопросы. Оставить их можно в комментариях прямо под этой статьей или на тех же каналах и в ВК.
Спасибо, что дочитали до конца.
С уважением, Станислав Васильев, хирург-имплантолог.








Антон
Спасибо за статью !
Шеф Клиники ИН
Вам спасибо, Антон. Спасибо за то, что читаете наш сайт.
С уважением, Станислав Васильев.
Валерия
Спасибо вам огромное, без преувеличения — статья шикарная. Так подробно и доходчиво.
Не сомневаюсь, что вы профессионал своего дела, восхищена!
Шеф Клиники ИН
Спасибо Вам, что читаете наш сайт. Будут вопросы — всегда к Вашим услугам!
С уважением, Станислав Васильев.
Наталья
Здравствуйте уважаемый доктор Васильев, я живу в Германии. С большим интересом прочитала Вашу статью об остеопластике. У меня такая ситуация: был удален зуб 11 и был введён материал Bio Oss und закрыли мембраной, закрепил её двумя пинами. Материал Bio Oss в моем случае инфицировался. Я состою в группе, это пациенты у которых также возникли проблемы с этим материалом. На снимке DVT видно, что вокруг этого» комка» био осс, воспаление. Также видно и на панорамном снимке. Я уже живу с болью 4 года. Недавно была у другого врача и он предложил убрать этот материал. Уважаемый Станислав, хотела бы узнать Ваше мнение: что бы Вы сделали в этом случае? Приехать в Москву я бы смогла. Спасибо большое.
Шеф Клиники ИН
Наталья, добрый день. Сожалею, что с Вами это произошло. Но дело тут отнюдь не в материале, а в технологии и реализации самой операции. Для того, чтобы принять решение о дальнейших действиях, мне необходимы данные. Моя электронная почта stanislav@clinicin.ru, телефон +79154595824. Пожалуйста, пришлите мне имеющиеся у Вас снимки, включая КЛКТ, сделайте телефоном несколько фотографий области проведенной операции, пришлите их тоже.
Я посмотрю и подумаю, что можно сделать в Вашем случае.
С уважением, Станислав Васильев.